3 părți: Determinarea reactivului limitativ Calculul randamentului teoretic al produsului Calcularea procentului de randament
În chimie, randamentul reacției este cantitatea de produs care este obținută după o reacție chimică. Randamentul teoretic este cantitatea maximă a produsului obținut în condițiile celei mai eficiente reacții. În realitate, majoritatea reacțiilor nu sunt cele mai eficiente - randamentul real al unei reacții este adesea mult mai mic decât randamentul său teoretic. Pentru a exprima eficacitatea reacției, se calculează procentul de randament. utilizând următoarea formulă:% output = (ieșire reală / ieșire teoretică) x 100.
Partea 1 din 3: Determinarea reactivului limitator
- 1 Începeți prin a scrie o ecuație chimică echilibrată. Acest lucru vă va ajuta să exprimați în formă matematică reacția viitoare.
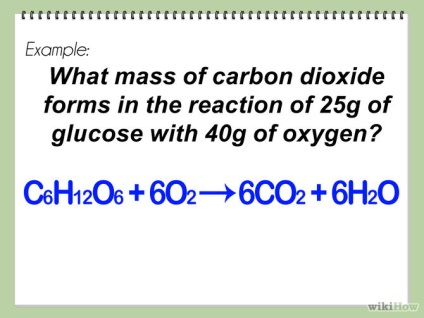
- Dacă nu sunteți sigur cum să scrieți sau să echilibrați ecuația chimică, citiți articolul wikiHow: Cum să scrieți o ecuație chimică și să o echilibrați.
- 2 Identificați reactivii utilizați. Ele sunt înregistrate, adesea, în partea stângă a săgeții în ecuația chimică. Ele sunt numite și "materiale inițiale". Puteți avea (la fel ca în partea 2) un singur reactiv.

- Numerele de lângă reactivi, dacă există, se numesc coeficienți. Acestea arată raportul în care sunt utilizați reactivii.
- Reactivul limitator este materialul inițial, care se va termina primul. Într-o reacție în care există mai multe materiale inițiale, dacă nu folosiți toate materialele inițiale de aceeași cantitate molară într-un raport de 1: 1 unul față de celălalt, unul dintre reactivi se va termina mai întâi, ceea ce va opri reacția.
- 3 Calculați cantitatea (în moli) a fiecărui reactiv. Pentru a face acest lucru, împărțiți masa reactivului în masa molară proprie.
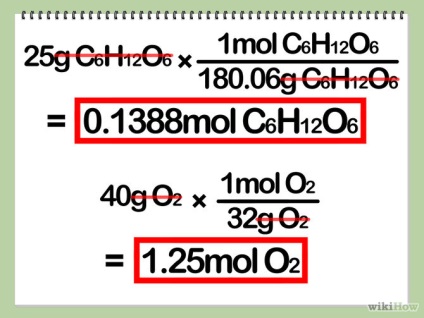
- Pentru a calcula masa molară a unei moli, adăugați masele atomice ale tuturor atomilor. Masa atomică a unui atom este un număr zecimal scris sub semnul chimic al fiecărui element din tabelul periodic. Amintiți-vă că orice număr indexat în moleculă înseamnă că aceste atomi apar mai mult decât o dată.
- 4 Dacă aveți doi reactivi, comparați raportul dintre molii reactivilor și raportul dintre coeficienții lor. În consecință, aceste relații se numesc "raport real" și "raport stoichiometric".

- Dacă raportul efectiv este mai mult decât stoichiometric, înseamnă că reactivul este "în exces", de aceea celălalt reactiv este limitator.
- Dacă raportul efectiv este mai mic decât stoichiometric, atunci acest reactiv este limitator.
- 5 Dacă utilizați mai mult de doi reactivi, va trebui să calculați numărul de moli ai produsului fiecărui reactiv după terminarea reacției. Reactivul care produce cea mai mică cantitate de produs este un reactiv limitator.

- Pentru a calcula numărul de moli primiți după sfârșitul reacției, trebuie să multiplicați cantitatea de reactiv în raport cu coeficientul produsului și factorul de reacție.
- Efectuați astfel de calcule pentru fiecare reactiv.
Partea 2 din 3: Calculul randamentului teoretic al produsului
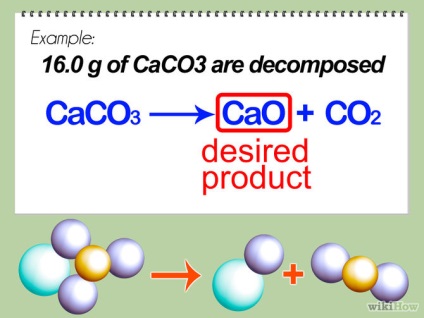
- 1 Determinați produsul dorit. Acesta, cel mai adesea, este scris în dreapta, în raport cu săgeata din ecuația chimică. În acest exemplu, CaO este produsul dorit (CO2 este gaz și se dizolvă în aer). Vom calcula soluția teoretică - calculul cantității de produs pe care sperăm să o primim în condițiile celei mai eficiente reacții.
- "De exemplu": Claire creează 0,45 grame de azotat de amoniu. Se așteaptă să obțină un randament teoretic al unui produs cu o masă de 0,50 grame. Care este procentajul de ieșire?
- 0,45 / 0,50 = 0,9. Înmulțiți acest rezultat cu 100 pentru a calcula procentajul.
- Procentul de randament este de 90%. Înregistrați greutatea fiecărui material inițial.
- 2 Se transferă greutatea reactivului de restricție la numărul de cariere. Puteți face acest lucru împărțind masa reactivului cu masa molară, ca în prima parte a etapei 3.
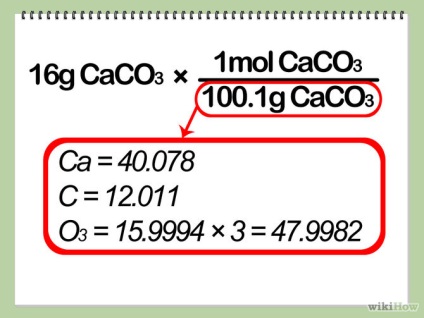
- 3 Determinați relația experimentală. Împărțiți numărul de cariere ale produsului dorit cu numărul de cariere ale reactivului limitator. Acest număr se numește relația experimentală.
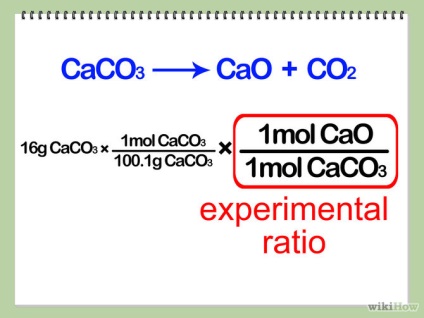
- 4 Calculați masa molară a unui mol de produs. Scrieți acest raport în ecuația dvs. de creștere, după cum se arată mai jos.
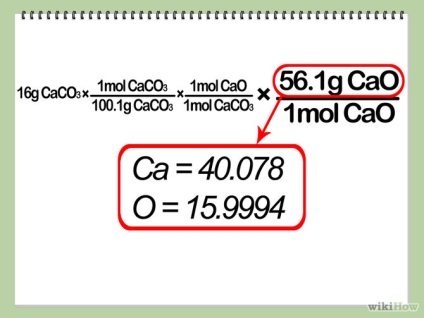
- 5 Prezintă o soluție teoretică. Se multiplică cantitatea de moli a reactivului de legare cu raportul dintre coeficientul produsului și factorul limită de reactiv și apoi se înmulțește cu raportul de masă molară a produsului. Acest lucru vă va oferi cantitatea de produs pe care o veți primi, în cazul în care reacția dvs. este cea mai eficientă (cu alte cuvinte, "ieșirea teoretică" a reacției).
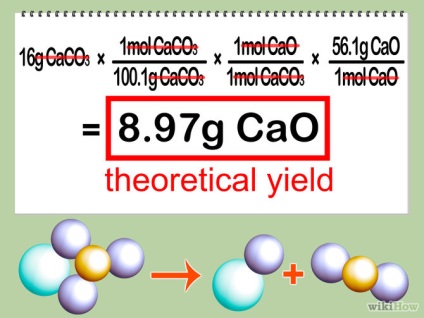
Partea 3 din 3: Calculul procentului de randament
- 1 Reacție. Luați produsul net rezultat din reacția dvs. și calculați greutatea sa echilibrată. Calculați masa.
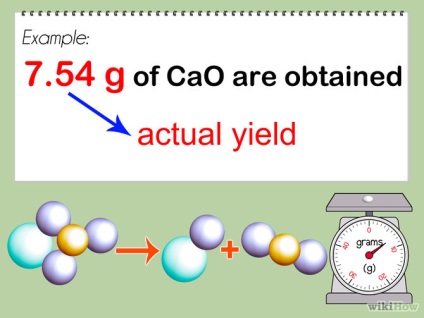
- 2 Calculați masa produsului în cariere, împărțind masa acestuia la greutatea moleculară. Acest lucru se face, de asemenea, așa cum este descris în etapa a doua, partea 2 de mai sus. Înregistrați numărul de moli obținut în cursul experimentului ca randament real.

- 3 Calculați procentajul de ieșire. Împărțiți ieșirea reală cu ieșirea teoretică și apoi înmulțiți rezultatul cu o sută. Ca răspuns, obțineți un procent care va arăta masa produsului dvs., în comparație cu masa de produs a reacției "ideale".

Editați avertismentele
- Există o probabilitate că veți calcula procentajul de ieșire care este mai mare de 100% fără a face o eroare matematică. Dacă produsul final nu este curat (contaminat cu substanțe care nu sunt considerate în ecuația chimică inițială), acești poluanți pot da o producție mai mare decât randamentul teoretic.
- Din acest motiv, este foarte important să curățați ușor produsele prin filtrare, uscare, distilare și orice alte procedee de purificare care vor varia în funcție de proprietățile fizice ale produselor dvs.
Trimiteți-le prietenilor: