sistem "mediu lichid - poros"
Pentru a înțelege în detaliu procesele interacțiunii fizico-chimice a sistemelor de dispersie și a unui mediu dispersat, luăm în considerare în detaliu structurile apei.
Se știe că molecula de apă este reprezentată de doi ioni monovalenți de hidrogen și de un ion de oxigen bivalent. Moleculele de apă nu sunt neutre din punct de vedere energetic. Acest lucru se explică prin faptul că atomii de hidrogen sunt adiacent la oxigenul din aceeași parte, ceea ce provoacă apariția unui moment electric. Conform altor date, ionii de hidrogen și oxigen din molecula de apă sunt localizați la vârfurile unui triunghi isoscel, iar unghiul la vârful triunghiului ocupat de ionul de oxigen este de 105 °.
Dipolaritatea moleculelor de apă determină capacitatea lor de a intra în comunicare unul cu celălalt, atrăgând polii semnului opus. Aceasta conduce la faptul că structura apei este, ca atare, o structură liberă. Volumul său real depășește valorile calculate.
Pentru a explica absența electroneutralității moleculei de apă poate fi, de asemenea, după cum urmează. Un atom de hidrogen care are o orbită stabilă este capabil să formeze numai o singură legătură covalentă. Cu toate acestea, în ciuda acestui fapt se dovedește că în unele cazuri un atom de hidrogen poate lua în sine și prin urmare să lege doi atomi împreună. În acest caz, există deja o legătură ionică, adică care se bazează pe atracția Coulomb între corpurile încărcate opuse. O astfel de legătura cu hidrogen este mai probabilă decât mai mulți atomi electronegativi conectați prin hidrogen. Ionul de oxigen are o încărcătură negativă ridicată și prin urmare formează ușor legături de hidrogen cu ioni de hidrogen. Datorită acestui fapt, moleculele de apă pot fi ușor asociate între ele în complexe. Structura apei se schimbă. Schimbarea lui este posibilă și la suprafața fazei solide.
Prezența unui câmp electric în apropierea moleculei de apă determină, de asemenea, puterea extraordinară a solventului, forțele de interacțiune dintre particulele încărcate în apă scad de 81 de ori. Ca rezultat, forța din legătura moleculară devine insuficientă, iar particulele sub acțiunea mișcării browniene devin o soluție.
Dipolii pot fi atrasi de ioni datorită atracției reciproce a încărcărilor electrice inerente, pe de o parte la ionul a, iar pe de altă parte - polizelor moleculelor de apă. Acest fenomen se numește hidratarea ionilor și se exprimă în formarea unei cochilii hidratate în jurul ionilor, constând în ionii atrăgători ai moleculelor de apă. Având în vedere dimensiunile diferite ale ionilor, este posibil să se prevadă în avans că mărimea acestor cochilii de hidratare va fi diferită pentru diferiți ioni.
În prezent, structura solidelor a fost studiată detaliat. Se bazează pe modele cum ar fi bile rigide, sfere cu atracție și bile elastice. Ca o consecință, există teorii cantitative ale lichidelor, cum ar fi gazele ideale, metalele parțial lichide și unele lichide moleculare. Pentru fluidele asociate cu legături de hidrogen, în prezent nu există o teorie satisfăcătoare.
În literatura de specialitate, structura norului de electroni modelul principal tetraedrică descris, cu un atom de oxigen la centru și doi atomi de hidrogen de la vârfurile și două sarcini negative simbolizând perechi de electroni izolate în celelalte două vârfuri ale tetraedru.
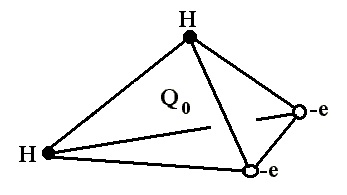
Prin urmare, molecula de apă poate participa la patru legături de hidrogen: în două datorită protonilor și în două datorită perechilor neparticipați ai unui atom de oxigen. Comportamentul apei este de asemenea determinat de orientarea rotirilor nucleare ale celor doi protoni. Cele mai comune modele structurale ale apei sunt cluster, clathrate și continuu (continuu).
În modelul cluster (J. Nemethi, N. Sherega), modelul de apă este prezentat sub formă de clustere, adică într-o anumită zonă a moleculelor nu sunt legate între ele într-o altă conexiune. În acest caz, există posibilitatea dezintegrării clusterelor, apariția de noi clustere.
Modelul clathrate (Samoilov S. Ya.) Asigură formarea unei rețele de legături de hidrogen între moleculele de apă, în interiorul cărora există goluri umplute cu molecule monomere (care nu au legături de hidrogen).
Modelul continuum (I. Pople) prevede absența moleculelor de apă cu legături de hidrogen sparte, care formează asociați inelari.
Structura complexă a apei determină proprietățile sale specifice, precum și dependența de temperatură.
Iată câteva dintre ele:
Suprafața specifică a colectorilor de petrol și gaze deseori ajunge la mii de metri. Prin urmare, există o interacțiune de suprafață între lichidul de filtrare și colectorul de la interfețe. Această interacțiune are un efect semnificativ asupra filtrării.
Cea mai importantă caracteristică a interfeței de fază este tensiunea superficială. Se știe că tensiunea superficială la limita gazului lichid depinde de mulți factori - compoziția chimică a lichidului și gazului, temperatura, presiunea și alți factori. Pe măsură ce crește temperatura și presiunea, tensiunea superficială scade. Natura schimbării tensiunii de suprafață la interfața ulei-lichid este mai complexă. Dacă uleiul este degazat și nu conține aproape niciun element polar, tensiunea de suprafață la limita apei este practic independentă de temperatură și presiune. Dacă uleiul conține componente polar solubile în apă, atunci, pe măsură ce crește presiunea și temperatura, tensiunea superficială la limita cu apa poate crește. În prezența gazelor solubile, dependența devine mai complicată.
Este dificil să măsurați direct tensiunea superficială pe suprafața unui corp solid. În acest caz, tensiunea superficială este evaluată indirect prin schimbarea unghiului de contact de umectare, care servește și ca măsură de umectare a suprafeței solide de către lichid. Suprafața unui corp solid este umezită cu atât mai bine, cu atât mai mică este diferența de polaritate dintre corp și lichid. Lichide foarte polare, adică având o tensiune superficială la suprafață, umeziți suprafața tare mai rău decât polaritatea scăzută. De exemplu, mercurul umește numai anumite metale, în timp ce o apă lichidă mai puțin polară umezește nu numai metale, ci și multe minerale și mai puține uleiuri polare - toate solidele.
Unghiul umezelii depinde de mulți factori. Procesele de adsorbție au o influență deosebit de mare asupra acesteia. De exemplu, tratamentul agenților tensioactivi poate crește în mod semnificativ capacitatea de umectare și viceversa.
În timpul deschiderii rezervorului și în timpul fazei de dezvoltare, interfața nu rămâne stabilă: în momentul deschiderii, uleiul este împins din puț, în timp ce stăpânește opusul. Cu această schimbare în direcția mișcării, unghiul de umectare se schimbă, de asemenea.
Articole similare
Trimiteți-le prietenilor: