alcoolați
Alcoolați. produsele de substituție ale atomului H din molecula de alcool pe metal (M).
Alcoolații alcoolilor cu un singur alcool. Formula lor generală este M (OR) n. unde n este gradul de oxidare a metalului. Alcaline alcaline, click-to-earth. metale, T1 (1) și alcooli primari-compușii ionici; non-topire, non-volatile; t. diverse 200-300 ° C; solubil în alcooli și NH3 lichid; electroliți în soluție. De obicei, soluțiile de alcool sunt izolate sub formă de solvați de cristal. Derivați ai metalelor din grupele III-VIII și alcooli (începând cu C2H5OH), precum și compuși monomeri sau oligomeri M1 OR-mpem; au puncte de topire și puncte de fierbere scăzute; foarte solubili în solvenți nepolari, alcooli slab utilizați; soluțiile nu conduc curentul. Mietilații acelorași elemente sunt de obicei coordonate. polimeri; non-topire, non-volatile; nu solubilitate. în nici unul dintre solvenți. Majoritatea elementelor ALCOHOL din mijlocul sistemului periodic combină proprietățile compușilor ionici și moleculari (vezi Tabelul). Toți alcoolii sunt foarte higroscopici.
CARACTERISTICI ALE ALCOOLELOR [M (OH) n] m
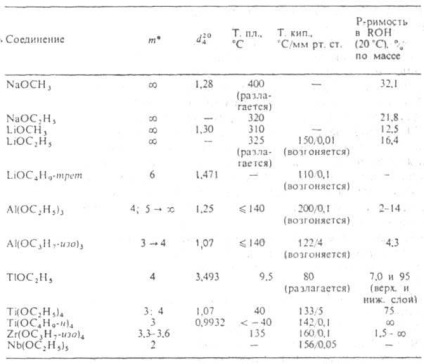
* t-grad de asociere; săgeata arată variația lui m cu îmbătrânire.
Cu extensia lui R la omologie. punctul de topire, densitatea, indicele de refracție, solubilitatea în alcool sunt de obicei reduse, iar punctul de fierbere (sublimare), evaporarea H și S, creșterea vâscozității. Spații. Dificultățile care cresc în trecerea de la primar R la secundar și terțiar împiedică asocierea moleculelor. În aceeași serie, punctul de fierbere (vezi figura 1), viscozitatea și solubilitatea în solvenți nepolari scad. ALCOHOLELE unui număr de metale polivalente, de exemplu Al, Ga, Ti, Fe (III), formează mai mulți asociați cu compoziție și structură diferite (de exemplu, formulele VI și IX). Moleculele lor oligomerice și polimerice sunt capabile de conversie reciprocă, astfel încât proprietățile fizice și chimice și reactivitatea preparatelor individuale ALCOOLATE pot varia în limite foarte largi (vezi figura 2).
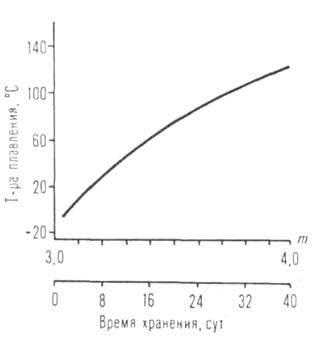
Fig. I. Dependența temperaturii de fierbere a amiloizilor izomerici Ti, Mb, Al, U asupra ramificării R.
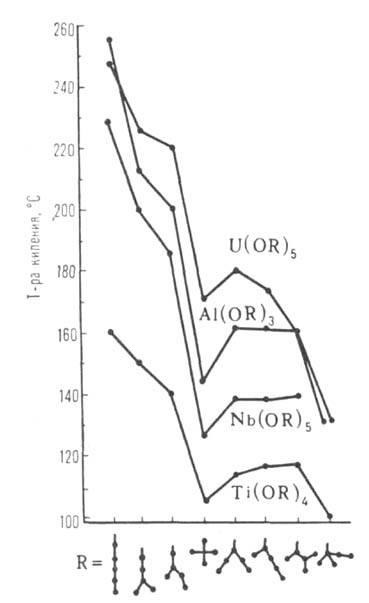
Fig. 2. Dependența temperaturii de topire [Al (OC3H7-iso) s] t asupra gradului de asociere (t) și a timpului de păstrare (de la debutul cristalizării).
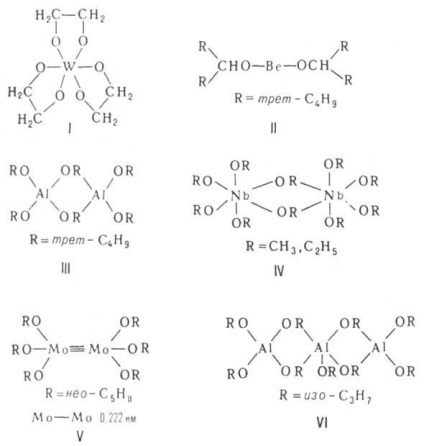
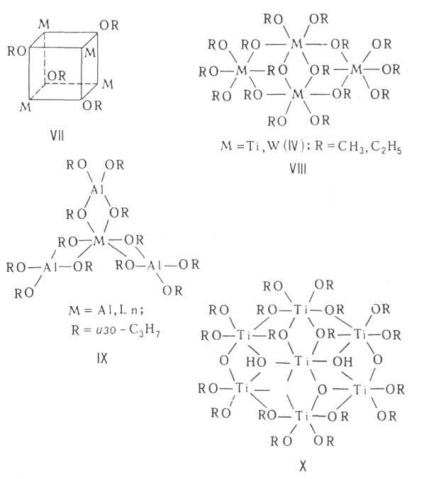
asociați cu structura determinată de principiul „min. Gradul de polimerizare“, în care toți atomii M ating o coordonare stabilă. numere (datorate interacțiunii donor-acceptor între Orbitali libere perechi M și atomi de electroni grupe alcoxi ale moleculelor adiacente). monomeric alcoxid numai în cazul unor grupări alcoxi foarte polidentați sau ramificate (vezi. Formula I, II). Asociații pot avea o structură diversă. Dimerii sunt capabili să formeze o structură a două poliedre, de exemplu tetraedre (III) sau octaedrii (IV) cu o muchie comună (OR) 2. grupări de Mo sau W conținând legături multiple M-M (V). Moleculele sunt în mod tipic trimeri cyclol-linear-chain (VI), tetramerii cub (TYUSN3. KOS4 H9 -T, CH3 ZnOCH3. VII), molecule plane de patru octoedre cu aripioare comune (VIII) sau o moleculă cu un octaedru central și trei tetraedre de muchiile sale (IX). Metoxidul, etoxidul și alcalină izopropoxid și schel.-land. metalele formează cristale polimerice. structura straturilor de tetraedre (cum ar fi anti-PbO) și octoedre [tip Ca (OH) 2], respectiv.
. Complexarea cu alcooli, însoțită de eliberarea de solvați cu cristale stabile [de exemplu, LiOCH3 * 2CH3 OH, m diferit de 28 ° C; NaOC2H5 * 2C2H5OH, adică diferite 200 ° C; Ca (OC2 H5) 2 * NS2 H5 OH, în care n = 4 și 2, adică. Înaltă și 60 100 ° C], este caracteristic alcoolati principal alcaline și schel.-land. metale; în cazul metalelor solvați cu alcooli polivalenți și alții. baze Lewis sunt instabile, deoarece funcția acceptor M este satisfăcută datorită formării de punți solide sau asociați în molecule. solvații cunoscuți [M (OC3 H7 -izo) 4 * L] 2. unde M = Sn, Zr; L = = i-C3 H7 OH, THF, piridină, 2Timotei (OR) 4 * En, 2AL (OC3 H7 -izo) 3 * En [En = (- CH2 NH2) 2], suferă ușor desolvatare. Cu toate acestea, Al [OCH (CF3) 2] 3 * L [L = (C2 H5) 2 O, (C2 H5) 3 N, (C2 H5) 3 P] este distilat în vid, fără a se descompune.
Când doi alcooli diferiți interacționează într-o soluție sau într-o topire, se formează bimetalic. A. (Meerwein alkoxosols), pentru care proprietățile compușilor moleculari sunt mai caracteristice decât pentru componentele care le formează. Astfel, Mg [Al (OC2H5) 4] 2, spre deosebire de etilații polimerici Mg și Al, este solubil nelimitat în solvenți organici, distilat la 195 ° C / 0,1 mm Hg. (punct de topire 181 ° C), formează dimeri care sunt foarte stabili în faza gazoasă și soluție. Complexarea ALCOOLULUI cu halogenuri metalice conduce la halogenuri de alcooxi-M (OR) n Halm. Anhidridele de acizi minerali în interacțiune cu alcoolii formează săruri ale acizilor alchilați:
unde DX2 = CO2. SO2. CS2; M = Na, Cu. ALCOOLII de tipul (iso-RO) 3 Mo = Mo (OR-iso) 3 se leagă în mod reversibil la CO, CO2 și ireversibil la O2. NO, C2H2; Liganzii atașați L (cu excepția O2 și NO) devin legați prin punte:
Cu compușii care conțin un atom de H activ, alcoolati intră în reacție de schimb: M (OR) n + n HX -> MXN + n ROH, unde X = Hal, OH, OR, SH, NH2, etc. Reacția este larg utilizată în sinteza anhidră. derivaților anorganici și organici ai metalelor, ca singurul produs secundar în acest caz de alcool.
Sub hidroliza controlată, ALCOOLI de metale polivalente cu urme de produse de cristalizare a umezelii conținând poduri oxo (vezi, de exemplu, formula X). Produse finale de hidroliză ALCOOLE - hidroxizi; ele sunt foarte reactive, formează hidrogeluri stabile și deshidratează la temperaturi foarte scăzute, cu formarea de oxizi fin dispersați.
În reducerea oxidării. reacțiile însoțite de o schimbare a gradului de oxidare a M intră în principal alcoolii metalului de tranziție (reacția este utilizată pentru a produce aceleași metale în noi stări de oxidare). ALCOOLELE sunt alcaline sau click-to-earth. metale, se obține interacțiunea metalului cu alcoolul. Uneori această reacție se efectuează într-o soluție de hidrocarbură sau NH3 lichid. Beriliul, Al, Y, Ln reacționează cu alcooli în prezența HgCI2. I2. HHal sau halogenuri ale acelorași metale. Alcoolații din Ge, Ti, Zr, Nb, Ta, Y, Sc și La sunt obținuți prin oxidarea anodică a metalului în alcool în prezența aditivului conductiv [R4N] Br. Alcoolații alcalini, clic-la-pământ. metalele T1 (I), V (V), Mo (VI), Re (VII), Os (VIII) sunt de asemenea obținute prin alcooliza oxizilor sau hidroxidelor lor:
Echilibrul este deplasat spre dreapta prin legarea sau îndepărtarea apei prin distilare. Metoda de sinteză a ALCOOLULUI ALCOOLIC al unui număr de compuși este destul de universală:
unde X = H, R ", NH2. NR2. N [Si (CH3) 3] 2 - Cu toate acestea, aplicarea acestei metode este limitată de dificultățile de sinteză a MXn. A este de asemenea sintetizat prin alcoxilarea clorurilor metalice cu alcooli alcalini sau un amestec de NH3 cu ROH, de obicei într-o soluție alcoolică sau alcool-benzen, de exemplu:
unde M = Na, Li, NR4; n3. În sinteza alcoolilor solubili, se utilizează NaOR (precipitări de NaCI), în sinteza insolubilă, de exemplu metilații, -LiOR (LiCl este solubil în CH3OH). Reacția are loc prin formarea bimetalică. ALCOOLE Modificarea metodei este interacțiunea dintre sărurile de piridiniu disponibile ale clorometalatului cu NH3.
unde Py = piridină, M = Zr, Ce (IV), Pu (IV), UO 3+. UO2 2+. Equilibrium "transesterificare" alcoxid alcool al :. M (OR) n + n R »OHM (OR») n + n ROH drept deplasare ROH distilare azeotropă cu benzen sau introducerea repetată a unor noi porțiuni ROH. Dacă ambele temperaturi apropiate de fierbere alcooli de schimb potrivit ester ROH:
ALCOOLIILE unui număr de metale tranziționale pot fi obținute prin reducerea oxidării. reacții, cum ar fi oxidarea Cr (OR-t) 3, oxigen, brom sau Pb (CH3 COO) 4 și Cr (OR-t) 4. Oxidanții sunt esteri, de exemplu U (OR) 5 sunt convertite la acțiunea lor în U (OR) 6. Recuperarea (NH4) 2 CrO4 într-o soluție alcoolică sub iradiere UV duce la Cr (OR) 3; Ti (OR) 4 este redus la metal. K la Ti (OR) 3. Alcoolații alcooli monohidroxilici se utilizează pentru reducerea selectivă a C = O (cm. Meervepna-Ponndorfa-Verley reacție reacție Oppeiauera), în calitate de catalizatori pentru disproporționarea aldehidelor (vezi. Reacția Tishchenko), polimerizarea de condensare, și altele. Alcalină Agenții alcoolat-alcoxilare (vezi. Williamson sinteza). Alcoolații Al și Ti repelenți și agenți de reticulare pentru rășini epoxidice și poliester, polimeri de silicon. Produsele de hidroliză și alcoxidici piroliza acoperiri rezistente la căldură-poliorganometalloksany componente parțiale. Datorită alcoolatii rezultat hidroliza lor, piroliza sau oxidarea cu puritate ridicată este obținută și oxizi metalici activi.
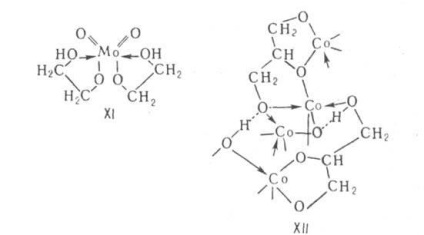
Alcoolații de glicoli și alcooli polihidrici. Naib. S-au studiat alcoolii de glicerol (glicerați) și alcoolii de glicoli (glicolați). ALCOOLI de alcooli polihidrici și glicoli-chelați (monomeri, oligomeri) sau polimeri conținând liganzi polidentați. Chelații se găsesc cel mai adesea în alcoolii cu grupări OH neînlocuite în alcoolul original (de exemplu, formula XI). Astfel de alcooli tind să formeze solvați cu alcooli. Ele sunt cristale higroscopice; derivați de alcalin și pământ clic. metalele sunt solubile în alcooli, se descompun sub 200 ° C, derivații sunt multivalenți. (Co, Ti, etc.) solvenți. de asemenea în solvenți nepolari, volatili și cu punct de topire scăzut. Polimeri polimorfici alcoolici complet substituiți, mai puțin deseori cristalini (de exemplu, gliceratul Co cu formula XII). Spre deosebire de M (OAlk) n, ele sunt rezistente la hidroliză, insolubile, non-topice, rezistente la căldură.
Alcoolii cu un singur substituent se formează prin acțiunea asupra alcoolilor polihidrici și a diolilor în exces de pământ alb alcalin. metal sau MOAlk; alcoolii complecși substituiți ai acelorași metale - disproporționarea la temperaturi ridicate:
2NaO (CH2) 2OH NaO (CH2) 2ONa + HO (CH2) 2OH
Glicolații cu două grupe și glicerile trisubstituite din metale polivalente dau interacțiunea dintre oxizi, hidroxizi, M (OAlk) n. oxalati, acetați, respectiv, cu glicol sau glicerol la temperaturi de peste 250 ° C
O clasă specială de produse piroforice este interacțiunea CO cu alcalin sau cis-pământ. metale (considerate anterior "săruri de hexaoxibenzen"). Ei sunt derivați cu două substituții ipotetice. acetilene diol HOSSON.
Enciclopedii chimice. Volumul 1 >> La lista articolelor
Articole similare
Trimiteți-le prietenilor: