Elemente ale grupului 6 din principalul subgrup. Numele foarte folosit - HALKOGENIA - "Producerea minereurilor". Cred că prin acest nume sunt mai obligați să aibă sulf decât oxigenul
În formatul de pregătire pentru UTI, vom lua în considerare proprietățile fizice și chimice ale celor două elemente - oxigenul O și sulful S.
Dar nu este așa de simplu.
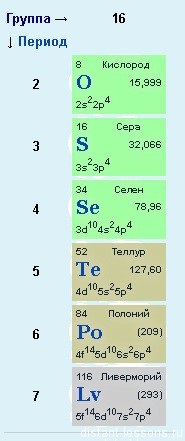
Nu există plângeri cu privire la oxigen - are o structură electronică care corespunde formulei generale, dar sulful și alte elemente au alte opțiuni ... Dacă privim în detaliu structura elementelor p în funcție de perioade. atunci trebuie să fiți atenți că din a treia perioadă, elementele p au o d-orbită liberă, pe care electronii pot merge.
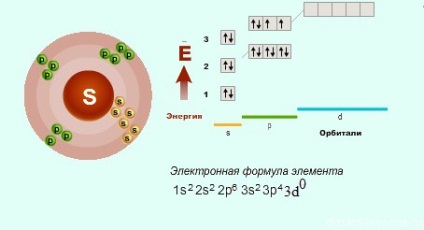
Acesta este motivul pentru care gradul de oxidare a sulfului nu poate fi doar -2.
- Valence a elementelor:
- valența de oxigen = 2,
- valența sulfului este 2.4.6
- Grade de oxidare:
- Gradul de oxidare a oxigenului -2 - tipic oxidant puternic, nemetalic;
- gradul de oxidare a sulfului = -2 (gradul minim de oxidare), +2 (rar), +4, +6 (starea maximă de oxidare) în s.o. S vor prezenta proprietăți de restaurare. în maxim - oxidativ.
- De la partea de sus în jos în subgrup, raza atomului crește, prin urmare, electronii sunt din ce în ce mai atrase de nucleul atomului, prin urmare, proprietățile metalului cresc de sus în jos.
- Ca o consecință, din partea de sus în jos în subgrup, proprietățile reducătoare sunt îmbunătățite.

Sulful-S este un solid, deși scriem formula pentru această substanță ca S., dar se formează de obicei cristale de S4 și S8. De obicei, sulful este o substanță din material plastic de culoare maro sau brună.
În aer, arsurile cu sulf: S + O2 = SO2 (gaz incolor cu un miros înțepător)
- Hidrogen + oxigen:
- 2H2 + O2 = 2H2O este o reacție calitativă la oxigen - procesul se desfășoară cu un bumbac caracteristic.
- H2 + O2 = H2O2 - peroxid de hidrogen
- Metale + Oxigen:
- 4Li + O2 = 2Li2O - oxid de bază
- Non-metal + O2:
- S + O2 = SO2 - oxid de acid
- Oxizi + oxigen:
- 4FeO + O2 = 2Fe2O3 - reacția se efectuează cu oxizi bazici în stări de oxidare non-superioare
- 2SO2 + O2 = 2SO3 - reacția se efectuează cu oxizi acide în stări de oxidare non-superioare
Oxigenul poate prezenta proprietăți de reducere numai la un element care are mai multă electronegativitate, i. E. el trebuie să stea în sistemul periodic de elemente la dreapta oxigenului. Acesta este REGINA NON-METALELOR - F:
- F2 + O2 = OF2 (aici oxigenul prezintă o stare de oxidare de +2)
Trimiteți-le prietenilor: