La formarea moment și proprietățile complexe ale compușilor cu explicate în termenii teoriei metodei legăturilor de valență (BC), teoria câmpului cristal (TST) și teoria molecular orbital (MO).
Să examinăm pe scurt fiecare dintre aceste teorii.
Teoria metodei de legături de valență
Teoria amfibie consideră formarea ionilor complecși ca interacțiune donor-acceptor al perechilor de electroni și nepuse liber orbitali ligand agent de complexare.
Luați în considerare ionul complex [Co (NH3) 6] 3+
1s 2 2s 2 2p 6 3s 2 3p 6 4s 0 3d 6 4p 0 4d 0
În conformitate cu regula lui Hund, electronii la nivelul energiei externe sunt aranjați după cum urmează:
Agentul de complexare are numărul de coordonare al c.c. = 6, deci poate atașa 6 liganzi, fiecare dintre ele având o pereche de electroni neparticipați și este astfel un donor de electroni. Un acceptor (agent de complexare) pentru plasarea a șase perechi de electroni trebuie să asigure șase orbite vacante. Atunci când se formează un ion complex [Co (NH3) 6] 3+, patru electroni nepartiți în starea d de Co 3+ formează mai întâi perechi de electroni, ca urmare a eliberării a două orbite 3d:
Apoi se formează ionul complex [Co (NH3) 6] 3+. având următoarea structură:
Într-un orbital 3D și 4s și 4p orbale externe participă la formarea acestui ion complex. Tipul de hibridizare este d2sp3.
Prezența numai a electronilor perechi indică proprietățile diamagnetice ale ionului.
Teoria câmpului de cristal
Teoria câmpului de cristal se bazează pe presupunerea că legătura dintre agentul de complexare și liganzi este parțial ionică. Totuși, se ia în considerare influența campului electrostatic al liganzilor asupra stării energetice a electronilor ionului central.
K2 [Zn (CN) 4] - are o structură spațială tetraedrică (sp3 - hibridizare)
K3 [Fe (CN) 6] - are o structură spațială octaedrică (hibridizare sp3d2)
Agenții de complexare au următoarea configurație electronică:
d - electronii de același nivel de energie sunt aceiași în cazul unui atom sau ion liber. Dar acțiunea campului electrostatic al liganzilor contribuie la împărțirea nivelelor energetice ale d-orbitalilor în ionul central. Și divizarea este mai mult (cu același agent de complexare), cu atât este mai puternic câmpul creat de liganzi. Prin capacitatea lor de a provoca divizarea nivelurilor de energie, liganzii sunt aranjați într-o serie:
CN -> N02 -> NH3> SCN -> H2O> OH -> F -> Cl -> Br -> I -
Structura ionului complex afectează caracterul de despicare a nivelurilor de energie ale agentului de complexare.
În structura octaedrică a ionului complex, orbitalii dγ (dz 2 - dx 2 Y2- orbitali) sunt supuse unor puternice interacțiuni de câmp ligand. iar electronii acestor orbite pot avea o energie mai mare decât electronii d-orbitali (dxy.dxz, dyz-orbitals).
Divizarea nivelurilor de energie pentru electronii în starea d în câmpul octaedric al liganzilor poate fi reprezentată sub forma unei scheme:
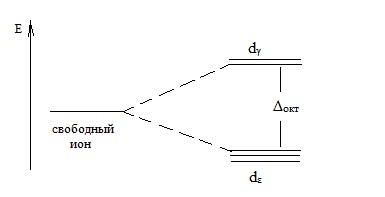
Aici Δoc este energia de divizare în câmpul octaedric al liganzilor.
În coordonare tetraedral orbitali dγ complex ion au o energie mai mică decât dε orbitale:
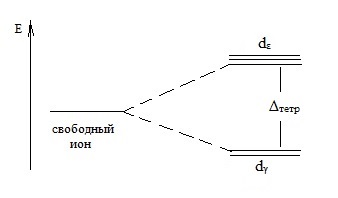
Aici Demp este energia de divizare în câmpul tetraedric al liganzilor.
Energia de divizare A este determinată experimental din spectrele de absorbție de către o substanță de cuante de lumină a cărei energie este egală cu energia tranzițiilor electronice corespunzătoare. Spectrul de absorbție, precum și culoarea compușilor complexi ai elementelor d, se datorează tranziției electronilor de la d-orbitalii cu cea mai mică energie la d-orbitalul cu o energie mai mare.
Astfel, în cazul sărurilor de K3 [Fe (CN) 6], absorbția cuantelor de lumină, tranziție probabilă a unui electron de la dγ dε orbital pentru orbital. Aceasta explică faptul că această sare are o culoare roșu portocaliu. O sare K2 [Zn (CN) 4] nu poate absorbi lumina și, prin urmare, este incoloră. Acest lucru se explică prin faptul că tranziția electronilor de la dg-orbital la d-orbital este nerealizabilă.
Teoria orbitalilor moleculari
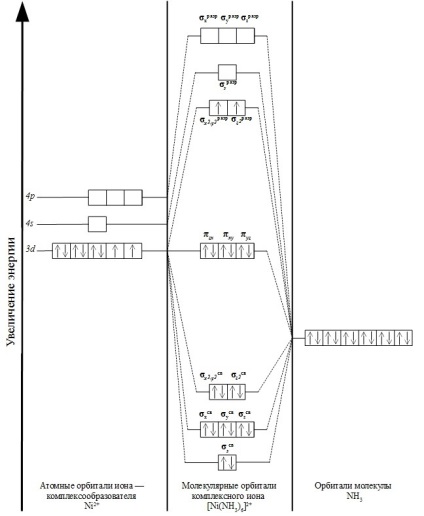
Folosind această metodă, prezentăm configurația electronică a complexului de ioni de înaltă spin [Ni (NH3) 6] 2+.
Configurația electronică a ionului Ni 2+:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 0 3d 8 4p 0 4d 0 sau ... 4s 0 3d 8 4p 0 4d 0
În ionul complex [Ni (NH3) 6] 2+, 8 electroni ai ionului central Ni2 + și 12 electroni ai șase liganzi NH3 iau parte la formarea unei legături chimice.
Ionul complex are o structură octaedrică. Formarea MO este posibilă numai în cazul în care energiile particulelor interacțioase inițiale sunt apropiate de valorile lor și, de asemenea, orientate în spațiu într-un mod adecvat.
În cazul nostru, orbitalul 4 al ionului Ni 2+ se suprapune în mod egal cu orbitele fiecăruia dintre cele șase liganzi. Ca rezultat, se formează orbitali moleculari: σs legarea σs și slsul σs de descărcare.
Suprapunerea celor trei orbite 4p ale agentului de complexare cu orbitele liganzilor conduce la formarea a șase orbitale spp: legăturile de legare σx. σy st. σz s și slăbirea σx a descărcării. de descărcare. σz dezagregat.
Suprapunerea dz 2 și dx 2 -y 2 complexanți liganzi orbitalii promovează formarea de patru orbitali moleculare: două σ legare x 2 -y comunicare 2. σ z legare 2 și σ antibonding doi biți x 2 - y 2. σ 2 z biți.
Orbitalele sunt dxy. dxz, dyz al ionului Ni 2+ nu se leagă la orbitele liganzilor. nu sunt direcționate către ei. Din acest motiv, ei nu participă la formarea legăturii σ și sunt orbali nelegați: πxz. πxy. πyz.
În total, ionul complex [Ni (NH3) 6] 2+ conține 15 orbitale moleculare. Aranjamentul electronilor poate fi reprezentat după cum urmează:
Schematic, formarea orbitalilor moleculari este prezentată în diagrama de mai jos:
Articole similare
Trimiteți-le prietenilor: