Aminele sunt substanțe organice care conțin azot, derivați de amoniac (NH3), în molecule din care unul sau mai mulți atomi de hidrogen sunt înlocuiți cu un radical hidrocarbonat (-R sau -CnH2n + 1)
Grupa funcțională: - gruparea amino NH2
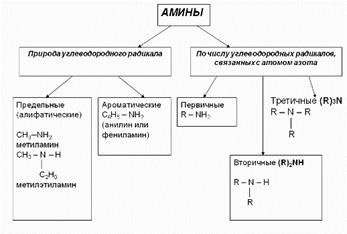
Aminele Nomenclatură 1. În majoritatea cazurilor, aminele formează nume din numele de radicali de hidrocarburi și un sufix amin.CH3 metilaminei-NH2 CH3-CH2-NH2 etilamină diferiți radicali, în ordine alfabetică. CH3-CH2-NH-CH3 Metil etilamină
În prezența radicalilor identici, se folosesc prefixele di și trei. (CH3) 2NH Dimetilamină
2. Aminele primare sunt adesea denumite derivați de hidrocarburi în care unul sau mai mulți atomi de hidrogen sunt înlocuiți cu grupe amino -NH2. În acest caz, gruparea amino este indicată în nume prin sufixe amină (o grupă -NH2), diamină (două grupări -NH2), etc. cu adăugarea cifrelor care reflectă poziția acestor grupuri în lanțul principal de carbon.
De exemplu: CH3-CH2-CH2-NH2-propanamină-1H2N-CH2-CH2-CH (NH2) -CH3-butandiamină-1,3
6. Izomerismul aminei Izomerismul structural
- carbon schelet începând cu C4H9NH2:
- izomerismul unei grupe amino, asociat cu o schimbare a gradului de substituție a atomilor de hidrogen sub azot, adică între tipurile de amine:
Prepararea aminei. Datorită mirosului, aminele inferioare au fost greșite de mult timp pentru amoniac, până în 1849 chemistul francez Charles Wurz a descoperit că, spre deosebire de amoniac, ard în aer cu formarea de dioxid de carbon. De asemenea, el a sintetizat metilamină și etilamină.
R-NO2 + 6 [H] t, kat-Ni → R-NH2 + 2H2O R-NO2 + 3 (NH4) 2S t, Fe în mediu acid → R-NH2 + 3S ↓ + 6NH3 ↑ + 2H2O
Alte moduri: 1). Industriale CH3Br + 2NH3 t, ↑ p → CH3-NH2 + NH4Br
2). Laborator - Acțiune alcalină asupra sărurilor de alchilamoniu [R-NH3] G + NaOH t → R-NH2 + NaH + H20
3). Acțiunea haloalcanilor asupra aminei primare alifatice și aromatice produce amine secundare și terțiare, inclusiv cele mixte.
8. Proprietățile fizice ale aminelor.
La temperaturi obișnuite numai aminele alifatice inferioare CH3NH2, (CH3) 2NH și (CH3) 3N - gaze (miros de amoniac), omologi mediu - lichid (miros de pește ascuțit), superioare - solide fără miros. Aminele amorfe sunt lichide sau solide cu punct de fierbere incolor. Aminele sunt capabile să formeze legături de hidrogen cu apă:
Prin urmare, aminele inferioare sunt ușor solubile în apă. Odată cu creșterea numărului și dimensiunii radicalilor de hidrocarburi, solubilitatea aminei în apă scade; obstacolele spațiale la formarea legăturilor de hidrogen cresc. Aminele aromatice în apă, practic rastvoryayutsya.Anilin (fenilamina) S6H5NH2 - o cheie de la amine aromatice: anilină este un lichid uleios incolor, cu miros caracteristic (p.f. 184 ° C, punct de topire - 6 ° C ....). În aer, se oxidează rapid și obține o culoare maro roșcat. E otrăvitor. Arderea (oxidarea completă) a aminei prin exemplul de metilamină: 4CH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
Acestea sunt compuși care conțin în moleculă simultan gr. -NH2 și -OH. Primul termen al seriilor de omologie
2-aminoetanol-1, monoetanolamină, colamină
Kolaminul face parte din lipide complexe. Derivații de colamină - dimedrol - au efect hipnotic antialergic și slab.
Kolamin pe gr. -NH2 prezintă proprietăți ale aminei și alcoolului.
P-ionii care curg prin -OH gr: cu Me, PC15, HCI, R-C1, R-COC1; de oxidare și deshidratare.
1. Interacțiunea cu metalele active.
2. Interacțiunea cu PCl5 și HCI (reacții SN)
3. Interacțiunea cu haloalcani:
4. Interacțiunea cu anhidridele acide:
1. Interacțiunea cu acizi tari conduce la formarea de săruri stabile.
2. Interacțiunea cu apa.
3. Interacțiunea cu anhidridele acide.
4. în reacția de alchilare, colamină formează un derivat metilat al tipului de hidroxid de amoniu cuaternar cuaternar-trimetiloxietil:
21. Acizi carboxilici și derivații lor. Caracteristică generală.
Acizii carboxilici sunt compuși care conțin o grupare carboxil
Clasificare. În funcție de numărul de grupe carboxil ale acidului carboxilic este împărțit în acizi monocarboxilici sau monohidroxilici (o grupare -COOH), dicarboxilici sau dihidric (două -COOH grupuri), etc. În funcție de structura de hidrocarbură scaun, care este conectat cu o grupă carboxil, un acid carboxilic sunt alifatici (de exemplu, acid acetic sau acrilic), aliciclică (de exemplu, ciclohexan) sau aromatic (benzoic, ftalic). Unii dintre reprezentanții acizilor carboxilici sunt enumerați în tabel. Nomenclatura. Numele hidrocarburilor corespunzătoare se bazează pe numele acizilor carboxilici. Prezența grupării carboxil este reflectată de acidul end-oic. Acizii carboxilici inferiori au adesea nume comune: formic, acetic, butiric și lanțul dr.Uglevodorodnuyu sunt numerotate începând cu atomul de carbon grupare carboxil, de exemplu:
CH3-CH = CH-COOH, acid buten-2-oic
Adesea, gruparea carboxil este considerată ca un substituent în molecula de hidrocarbură. Astfel, în utilizare fraza titlul „acid carboxilic“ și numerotarea atomilor de carbon ai atomului lanțului de carbon al grupării carboxil nu include: CH3 (CH2) 7 CH = CH (CH2) 7 COOH heptadecil-8-carboxilic (acid oleic)
Numele acizilor dicarboxilici sunt derivați din denumirea hidrocarburii corespunzătoare cu adăugarea sufixului "diol" și a cuvântului "acid". De exemplu, acidul etanic (oxalic) (HOOC-COOH).
Când se consideră gruparea carboxil ca substituent, numele acidului dibazic derivă din denumirea radicalului hidrocarbonat cu adăugarea expresiei "acid dicarboxilic". De exemplu, acidul malonic (HOOC-CH2-COOH) este numit acid metan dicarboxilic.
Izomeri. În acizii carboxilici, sunt posibile următoarele tipuri de izomerism:
1. Izomerismul lanțului de carbon. Începe cu acidul butanoic (C3H7COOH), care există ca doi izomeri:
2Isomometria poziției multiple de legătură, de exemplu:
CH2 = CH-CH2-COOH CH3-CH = CH-COOH
Acid buten-3-oic Acid buten-2-oic
(acid vinylacetic) (acid crotonic)
Izomerismul Cis-trans, de exemplu:
cis-buten-2-ova trans-buten-2-ova
Acid
4. Interclass exemplu izomerie, acid butiric esterul izomeric metilic al acidului propanoic (CH3-CH2-CH2-COOH) (CH3-CH2-CO-O-CH3) ester etilic al acidului acetic și (CH3-CO-O-CH2-CH3) .
5. Acizii hetero-funcționali au izomerism, legați de poziția grupărilor funcționale, de exemplu, există trei izomeri ai acidului clor:
CH3-CH2-CH2CI-COOH CH3-CH2CI-CH2-COOH
Acid 3-clorobutanoic al acidului 2-clorbutanoic
22. Proprietățile fizice și chimice ale acizilor carboxilici.
Proprietăți fizice. Acizii monocarboxilici alifatici saturați formează o serie omologă, caracterizată prin formula generală CnH2n + 1 COOH. Elementele inferioare ale acestei serii în condiții obișnuite sunt lichide cu miros acut caracteristic. De exemplu, acidul etanic (acetic) are un miros caracteristic "acetic". Acidul acetic anhidru la temperatura camerei este un lichid; la 17 ° C îngheață, transformându-se într-o substanță de gheață, denumită acid acetic "gheață". Reprezentanții medii ai acestei serii omoloage sunt lichide vâscoase, "uleioase"; deoarece C10 - solide. Acizii conținând 1-3 atomi de carbon sunt amestecați nelimitat cu apă.
Proprietăți chimice. Acizii carboxilici sunt acizi mai puternici decât alcoolii, deoarece atomul de hidrogen din grupul carboxi puternic are o mobilitate crescută datorită influenței grupului CO. Într-o soluție apoasă, acizii carboxilici sunt disociați: RCOOH RCOO- + H +
Cu toate acestea, datorită naturii covalente a moleculelor acizilor carboxilici, echilibrul de disociere de mai sus este suficient de puternic deplasat spre stânga. Astfel, acizii carboxilici sunt, de regulă, acizi slabi.
2. Formarea sărurilor. Acizii carboxilici au toate proprietățile acizilor obișnuiți. Ele reacționează cu metale active, oxizi de bază, baze și săruri de acid slab:
Acizii carbonici sunt slabi, prin urmare acizii minerali puternici îi înlocuiesc din sărurile corespunzătoare: CH3 COONa + HCI → CH3 COOH + NaCI.
Sărurile acizilor carboxilici în soluții apoase sunt hidrolizate: CH3 COOK + H20 CH3COOH + KOH. 4. O serie de proprietăți ale acizilor carboxilici se datorează prezenței unui radical carbon-hidrogen. Astfel, atunci când halogeni reacționează la acizi în prezența fosforului roșu, se formează acizi halogenați, cu atomul de hidrogen fiind înlocuit cu un atom de halogen la atomul de carbon cu o grupare carboxil (a-atom):
Acidul HCOOH acidic este caracterizat de un număr de caracteristici, deoarece conține o grupă aldehidică:
Acidul formic este un agent reducător puternic și oxidează ușor în CO2. Oferă reacția "oglinzii de argint":
În plus, acidul formic este oxidat cu clor: HCOOH + Cl2 → CO2 + 2HCl.
Într-o atmosferă de oxigen, acizii carboxilici sunt oxidați în C02 și H20: CH3COOH + 202 -> 2CO2 + 2H2O.
6. Reacții de decarboxilare. Acizii monocarboxilici nesaturați nesaturați sunt dificil de decarboxilați datorită rezistenței ridicate a legăturii CC la încălzire. Pentru aceasta, este necesară fuziunea unei sări de metal alcalin a unui acid carboxilic cu un alcalin:
23. Aminoacizi. Caracteristici generale: structură, nomenclatură, izomerism.
Aminoacizii sunt compuși în care grupările aminice și carboxil sunt simultan conținute. Cele mai simple aminoacizi au nume triviale. De obicei, aceștia sunt numiți substituiți cu acizi corespunzători, ceea ce denotă poziția grupărilor amino cu privire la literele acide # 945; # 946; # 947; # 948; etc. Există, de asemenea, nume pentru nomenclatura IUPAC:
glicină, glicină, aminoacetic, aminoetanol
lizină, # 945 ;, # 948; -diaminocaproic, 2,6-diaminohexanoic
Aminoacizii pot conține una sau mai multe grupări acide și diferă în bazicitate. O moleculă de aminoacizi poate include, de asemenea, mai multe grupări amino. În funcție de aranjamentul reciproc al grupărilor amino și carboxil, aminoacizii sunt împărțiți în # 945; -, # 946; -, # 947; -, # 948; -, # 949; - și așa mai departe.
2. În funcție de numărul de grupuri funcționale distinge între acid, neutru și de bază.
3. Natura hidrocarburii radical alifatic distinge (gras), aromatici și aminoacizi conținând sulf heterociclice. Aminoacizii de mai sus se referă la seria de grăsimi. Exemple de aminoacizi aromatici pot servi ca acid para-aminobenzoic:
Un exemplu de aminoacid heterociclic este triptofanul, indispensabil # 945; - aminoacid
NOMENKLATURa.Po nomenclatură sistematică, denumirile de aminoacizi sunt derivate din numele acizilor corespunzători prin adăugarea de prefixe și indicând amino-e locația de pe gruparea amino la gruparea carboxil. Numerotarea lanțului de carbon de la atomul de carbon al grupării carboxil.
IZOMERIYA1. Caracterizarea izomeriei scheletului de carbon
2. Isomerismul poziției grupurilor funcționale
3. Izomerismul optic
# 945; - aminoacizii, cu excepția glicinei NH2-CH2-COOH.
Articole similare
Trimiteți-le prietenilor: