Structura virusului imunodeficienței umane
Virionii HIV au aspectul unor particule sferice, al căror diametru este de aproximativ 100-120 nanometri (aceasta este de aproximativ 60 de ori mai mică decât diametrul eritrocitelor).
Compoziția virionilor maturi cuprinde câteva mii de molecule de proteine de diferite tipuri.
In interiorul capsida este un complexele ADN-proteină: cele două catene ale ARN-ului viral, ferm asociat cu o p7 proteină nucleocapsidă, enzime (revers transcriptaza, proteaza, integraza).
Capsidul asociază, de asemenea, proteinele Nef și Vif (7-20 molecule Vif per virion).
În interiorul virionului (și, cel mai probabil, în afara capsidului), se găsește o proteină Vpr8-11. În plus, aproximativ 200 de copii ale peptidil prolilizomerazei enzimatice celulare, care este necesară pentru asamblarea virionului, sunt asociate cu capsida HIV-1 (dar nu cu HIV-2).
72 de complexe glicoproteice Env sunt integrate în membrana lipidică. fiecare dintre care este format din trei molecule ale transmembranar glicoproteina gp41 (TM), angajat „ancora“ complex și trei molecule de gp120 glicoproteina de suprafață (SU).
Folosind proteina gp120, virusul se alătură receptorului CD4 și co-receptorului. localizate pe suprafața limfocitelor T umane. Raportul stoechiometric al p24: gp120 în virion este de 60-100: 1.
Proteinele gp41 și în particular gp120 sunt studiate intens ca ținte posibile pentru dezvoltarea de medicamente și un vaccin HIV.
În formarea anvelopei exterioare a virusului, apar și un număr de proteine de membrană celulară, inclusiv antigene leucocitare umane (HLA) din clasele I și II, și molecule de adeziune.
Funcțiile proteinelor structurale importante ale virusului HIV-1
Materialul genetic al HIV este reprezentat de două copii ale ARN pozitiv (+). Genomul HIV-1 are o lungime de 9000 de nucleotide. Capetele genomului sunt reprezentate de repetarea terminală lungă (LTR), care controlează producția de noi virusuri și poate fi activată atât de proteinele virale, cât și de proteinele celulei infectate. 9 genele HIV-1 codifică cel puțin 15 proteine.
Gena pol codifică enzimele: revers transcriptază (RT), integrază (IN) și protează (PR).
Gena gag codifică poliproteina Gag / p55, scindată de proteaza virală la proteinele structurale p6, p7, p17, p24.
Genele env codifică proteina gp160, scindabilă de către endina de endoprotează de celule, în proteinele structurale gp41 și gp120.
Celelalte șase gene - tat, rev, nef, VIF, VPR, VPU (VPX HIV-2) - codifică proteine responsabile pentru abilitatea HIV-1 de a infecta celulele și produc noi copii ale virusului. Replicarea HIV-1 in vitro este posibilă fără genele nef, vif, vpr, vpu, dar produsele lor sunt necesare pentru o infecție deplină in vivo.
Gag: poliproteină precursor gag / p55 este sintetizat din-lungime întreagă ARN genomic (care, în acest caz, servește ca un ARNm) în procesul de traducere standard, dependent de cap, dar sunt disponibile și IRES dependente de traducere. Precursori de proteine funcționale ale poliproteinei sunt aranjate în partea Gag / p55, după cum urmează: p17 ... p24 ... p2 ... p7 ... p1 ... p6 (p1 și p2 - cuplarea peptidelor; alte produse / p55 de scindare Gag descrise mai sus).
Proteina Gag / p55 ne-clivată conține trei domenii principale: domeniul de direcționare a membranei (M, direcționarea în membrană), domeniul de interacțiune (I, interacțiunea) și domeniul "târziu" (L, târziu).
Domeniul M situat în interiorul regiunii p17 / MA este mirizat (reziduurile acidului miristic sunt atașate) și direcționează Gag / p55 către membrana plasmatică. Domeniul I, situat în interiorul regiunii p7 / NC, este responsabil pentru interacțiunile intermoleculare ale monomerilor individuali Gag / p55. Domeniul L, de asemenea localizat în regiunea p7 / NC, mediază creșterea virionilor din membrana plasmatică; În acest proces, regiunea p6 a Gag / p55 de poliproteină participă de asemenea.
Vpu: Două funcții importante ale proteinei Vpu sunt:
1) distrugerea receptorului de celule CD4 în reticulul endoplasmatic prin atragerea de complecși ai ligazei ubiquitin și
2) stimularea virionilor alocare subsidiare din celule prin inactivarea proteinei transmembranare indusă de interferon CD317 / BST-2 care a primit numele de «tetherin» pentru capacitatea sa de a inhiba selectarea virionilor fiice nou formate prin retenția lor pe suprafața celulei.
Vpr: proteina Vpr este necesară pentru replicarea virusului în celulele care nu se divid, inclusiv macrofagele. Această proteină, împreună cu alte proteine celulare și virale, activează repetații lungi ale genomului HIV. Proteina Vpr joacă un rol important în transferarea provirusului la nucleu și determină o întârziere în diviziunea celulară în perioada G2.
Vif: proteina Vif joacă un rol important în susținerea replicării virusului. Tulpinile lipsite de această proteină nu sunt replicate în limfocitele CD4 +, câteva linii de limfocite T ("celule inaccesibile") și macrofage. Aceste tulpini sunt capabile să pătrundă în celulele țintă și să înceapă transcrierea inversă, dar sinteza ADN-ului proviral rămâne incompletă.
Nef: Proteina Nef îndeplinește mai multe funcții. Acesta inhibă expresia moleculelor CD4 și HLA de clasa I și II pe suprafața celulelor infectate, și, astfel, permite virusului sa scape de atacul limfocitelor T citotoxice și limfocite CD4 + de recunoaștere. Proteina Nef poate inhiba, de asemenea, activarea limfocitelor T prin legarea diferitelor componente proteice ale sistemelor de semnalizare intracelulare.
La maimuțele rhesus infectate cu virale, replicarea virală activă și progresia bolii sunt posibile numai cu gena nef intactă. Delețiile genei nef au fost detectate în tulpinile HIV izolate dintr-un grup de australieni cu un curs de infecție lung non-progresiv.
Cu toate acestea, unele dintre ele au prezentat în cele din urmă semne de progresie a infecției, inclusiv o scădere a numărului de limfocite CD4 +. Astfel, deși delețiile genei nef pot încetini replicarea virusului, aceasta nu garantează imposibilitatea completă a progresiei bolii.
Tat si Rev: proteine de reglementare Tat (trans-activator) și Rev acumulează în nucleul celulei și se leagă porțiuni specifice ale ARN-ului viral. proteină Tat are o greutate moleculară de aproximativ 14-15 kDa, se leagă structura secundară a ARN-ului genomic în apropierea regiunii 5'-netranslată activează HIV revers transcripția sintezei ARNm viral ARN genomic și este necesară pentru replicarea virală în aproape toate culturile celulare, reglează virionii ieșire din celulele infectate are nevoie de un cofactor celular - ciclon T1. proteina Rev regleaza expresia proteinelor virionului se leagă gena env ARNm în RRE (Eng. Rev element de răspuns) exon introni in gene despicate Tat si Rev.
Proteinele Tat și Rev stimulează transcripția ADN proviral și transportul ARN din nucleu în citoplasmă și sunt, de asemenea, necesare pentru traducere. Proteina asigură, de asemenea, transportul componentelor virusului din nucleu și comutarea sintezei proteinelor reglatoare ale virusului la sinteza structurală.
Diagrama arată fuziunea virionului HIV și membrana plasmatică a limfocitelor T umane
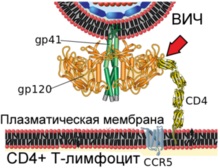
Etapa 1. Interacțiunea proteinei virale gp120 cu receptorul celular CD4 (indicat de săgeata roșie)
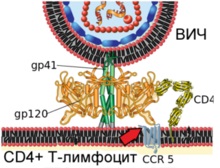
Etapa 2. Modificările conforme în proteina virale gp120 asigură legarea la receptorul celular CCR5 (indicat de săgeata roșie)
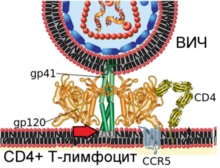
Etapa 3. Secțiunile finale ale proteinei virale gp41 penetrează membrana plasmatică a celulei (indicată prin săgeata roșie)
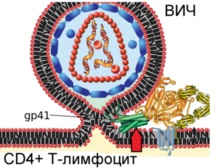
Etapa 4. Proteinele gp41 virale suferă modificări conformaționale semnificative, pliate în jumătate (indicată printr-o săgeată roșie) și formează o spirală care duce la convergența și fuziunea virionului și membranele celulare. Astfel, HIV captează limfocitele T în scopul reproducerii ulterioare.
Pătrunderea și integrarea
Infecția virală începe atunci când un virion HIV întâlnește o celulă umană care are un receptor CD4 pe membrana sa. Glicoproteina virală gp120 se leagă cu fermitate de receptorul CD4. Ca urmare a interacțiunii suferă o schimbare conformațională în gp120, care permit, de asemenea, de a lega o moleculă sau CXCR4 CCR5 coreceptor (exprimată pe suprafața limfocitelor T, macrofage, celule dendritice și microglia).
În funcție de capacitatea de a lega co-receptori pentru HIV este clasificat R5-tropic (se leagă numai CCR5), X4-tropic (leagă numai CXCR4) și R5X4-tropic (pot interacționa cu ambii co-receptori). Preparatele care blochează co-receptorii pot fi eficiente împotriva HIV.
După evenimentele descrise, membrana celulei și membrana virionului HIV se îmbină și conținutul virionului pătrunde în celulă. Proteina gp41 este foarte importantă pentru fuziunea membranelor, prin urmare este considerată o țintă pentru dezvoltarea de medicamente antivirale. In interiorul celulelor ARN-ul viral este eliberat din capsida, și are loc revers transcrierea - sinteza ADN bazat pe șablonul ARN genomic simplu spiralat catalizată de transcriptază inversă.
Majoritatea medicamentelor aprobate pentru utilizarea în infecția cu HIV au drept scop să perturbe activitatea de reverstranscriptază. ADN-ul sintetizat este transportat în interiorul nucleului celular și încorporat în cromozomul gazdei sub acțiunea integrazei. Mai multe medicamente care inhibă integraza trec prin primele etape ale studiilor clinice. ADN viral, încorporat în cromozomul celulei, se numește provirus.
ARN polimeraza umană din nucleul celular sintetizează ARN-ul de informații (mRNA), și mai târziu, de asemenea, ARN-ul genomic al virusului. ARN-urile sintetizate sunt transportate înapoi la citoplasmă, unde enzimele virale, proteinele structurale și reglatoare sunt sintetizate pe șablonul mRNA pe ribozomi.
Asamblarea și înmugurirea virionilor
ARN-ul genomic al virusului, precum și proteinele virale sunt transportate în locațiile ansamblului virion. Asamblarea virionilor are loc pe membrana, unde este trimis polistirenul myristyl Gag / p55. Virionii se formează inițial din precursori de poliproteină ai proteinelor structurale și enzimelor și în acest stadiu nu sunt infecțioase.
În timpul maturării particulei virale, proteaza virală scindează proteinele precursoare la componentele funcționale. Mai multe medicamente antivirale aprobate inhibă activitatea proteazei și împiedică formarea virionilor maturi.
Noile particule virale înmuguresc de pe suprafața celulară, captarea o parte a membranei, și afară, în fluxul sanguin, și o celulă gazdă care poartă receptor CD4, moare. Studii recente au arătat că procesul de virionilor înmugurire poate fi mai complexe decât se credea anterior. Astfel sa constatat că proteina Gag prin interactiunea cu componentele celulelor virioni se acumuleaza in corpurile multivehiculari intracelulare specifice, care sunt utilizate în mod normal pentru exportul de proteine. Astfel, particulele virale sunt eliberate din celule prin exploatarea sistemului de transport macromolecule proprii.
Răspândiți-vă de-a lungul corpului
În timpul fazei acute a infecției HIV, lipsa unui răspuns imun specific permite virusului să se replice activ și să atingă concentrații mari în sânge.
Virusul infestează organe ale sistemului limfatic, limfocitele CD4 +, CD8 + limfocite și macrofage și alte celule: macrofage alveolare ale plămânilor, celulele Langerhans, celulele dendritice foliculare ale ganglionilor limfatici, celule oligodendrogliale și astrocite ale creierului si gut celulelor epiteliale.
In tesutul limfatic al HIV proliferează pe tot parcursul bolii, care afectează macrofage activate și CD4 + limfocite Quiescent si celulele dendritice foliculare. Numărul de celule care conțin ADN proviral în țesutul limfoid este de 5-10 ori mai mare decât cea a celulelor sanguine, și replicarea HIV în țesutul limfoid cu 1-2 ordine de mărime mai mare decât în sânge.
Rezervorul de HIV este ganglionii limfatici și, în mod specific, celulele dendritice în care virusul persistă mult timp după perioada de viremie acută.
Pentru a activa limfocitele CD8 + și formarea unui citotoxic-antigen specific pentru limfocite T necesită prezentarea antigenului peptidic în combinație cu un antigen leucocitar uman de clasa I.
Celulele dendritice neobhodimye pentru inițierea răspunsurilor antigen-specifice primare, antigene sunt prelucrate și exprimate pe suprafața celulei, în cazul în care aceste antigene împreună cu molecule co-stimulatorii activa limfocitele T.
Celulele infectate nu adesea secretă molecule suplimentare de stimulare și, prin urmare, nu pot induce activarea unui număr suficient de limfocite B și T, a căror funcție depinde de celulele dendritice.
După terminarea transcripției inverse în limfocitele CD4 +, genomul viral este reprezentat de ADN-ul provizoric neintegrat. Pentru a încorpora ADN proviral în genomul celulei gazdă și pentru a forma noi virusuri, este necesară activarea limfocitelor T.
Contact CD4 + limfocite și celule prezentatoare de antigen în țesuturi limfoide, virusurile de pe suprafata celulelor dendritice foliculare și prezența citokinelor proinflamatorii (IL-1, IL-6 și TNFa) promovează proliferarea HIV în celulele infectate. Acesta este motivul pentru care țesutul limfoid reprezintă mediul optim pentru replicarea HIV.
În plus, această metodă a fost, de asemenea, eficientă în prevenirea infectării celulelor neinfectate. Această abordare poate duce la dezvoltarea unei modalități de a scăpa complet de infecția cu HIV.
Articole similare
Trimiteți-le prietenilor: