Formarea radicalilor liberi este posibilă sub acțiunea factorilor chimici și fizici, astfel încât inițierea polimerizării radicale este subîmpărțită în fizică și chimică (vezi schema)
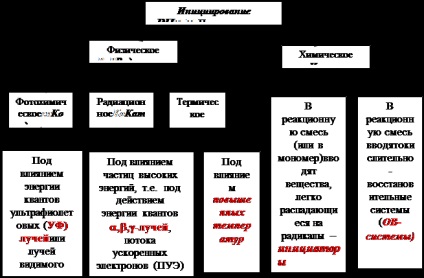
În tehnologia de producere a polimerilor, metodele chimice de inițiere sunt utilizate în mod predominant atunci când inițiatorii (J) sunt introduși în amestecul de reacție, substanțe care, în anumite condiții, se descompun ușor în radicali.
Grupul de inițiatori include următoarele substanțe (tabelul 10)
Tabelul 10 - Tipuri de inițiatori radicale
Formula (în formă generală)
Mecanismul de descompunere în radicali
Reprezentanții specifici ai inițiatorilor, condițiile și mecanismul de degradare a acestora sunt prezentate în tabelul 11.
Descompunerea ușoară și rapidă a inițiatorilor în radicali are loc prin legături de oxigen-oxigen sau carbon-azot, deoarece aceste legături au cea mai mică rezistență (energia de legare).
Energia de comunicare, kJ / mol
Cea mai scăzută temperatură de descompunere (50 ÷ 85 0 C) și, respectiv, cea mai mică energie de activare (E a) Inițiatori y, cum ar fi persulfatul de amoniu, acid azobisizomaslyanoy dinitril, peroxid de benzoil. Acești inițiatori sunt utilizați cel mai adesea în polimerizarea radicală.
Sistemele de reducere a oxidării (sisteme OB) sunt sisteme complexe care includ un oxidant și un agent reducător (promotor). Rolul oxidant cel mai adesea redate mai sus Inițiatori citate J (peroxizi, hidroperoxizi ai și altele.). Un promotor este o substanță care accelerează distrugerea inițiatorilor în radicali. Promotorii din sistemele OB sunt sărurile metalelor cu valență variabilă la cel mai mic grad de oxidare. cum ar fi clorura de fier a FeCl2 divalent. CuCl monovalent clorura de cupru, cobalt naftenat, naftenat de nichel (), etc. Pe lângă acești promotori, rolul jucat de amine, sulfiți, etc. promotorii industria vopselurilor - .. sicativi numite acceleratori de polimerizare.
Mecanismul de acțiune al sistemelor de reducere a oxidării este diferit. Cel mai simplu sistem OB este un reactiv Fenton - un amestec de peroxid de hidrogen H-O-O-H și FeCl2. În acest sistem, cationul instabil de Fe 2+ pierde cu ușurință electronul și ajunge la o stare de oxidare mai ridicată. Fe 3+. Electronul eliberat accelerează descompunerea peroxidului de hidrogen H-O ----- O-H în ionul HO - și radicalul HO ·.
Distrugerea inițiatorilor în radicali în prezența sistemelor OB este foarte rapidă și energia de activare a etapei de inițiere atunci când se utilizează sisteme OB este mai mică decât utilizarea numai a inițiatorilor chimici (Ea și (OB) <Е а и (J) ). Обычно энергия активации окислительно-восстановительного инициирования Е а и (ОВ ) составляет 42÷84 кДж/моль, а энергия активации инициирования с применением только инициаторов Е а и (J) равна 112÷170 кДж/моль.
Inițierea RP, i. formarea radicalilor liberi se desfășoară în două etape. care poate fi reprezentat schematic după cum urmează:
a) formarea radicalilor J, ca urmare a descompunerii moleculelor de inițiere J:
b) formarea radicalilor de creștere activă J-M + din moleculele de monomeri M:
Pe exemplul monomerului de clorură de vinii, această reacție este după cum urmează:
Etapa inițială (a) necesită întotdeauna energia de activare Ea și curge cu viteză mică și limitează întregul proces. Nu toți radicalii inițiatori J pot provoca a doua etapă b) și formează radicalii de creștere JM ·.
O parte din radicalii inițiatori dispare ca rezultat al reacției de recombinare inversă J + + J = J2.
Inițializarea fotochimică este utilizată mai rar decât inițierea chimică. În inițierea fotochimică, molecula de monomer M absoarbe energia fotonilor (hn) de radiație cu o lungime de undă de 100 nm Energia de activare a inițierii fotochemice Ea și (u / x) este mult mai mică decât energia de activare a inițierii pur chimice Ea și (Ea și (u / x) <<Е а и (J) ) и близка к 0 (Е а и (ф/х ) » 0 кДж/моль). Вследствие этого фотохимическая радикальная полимеризация может протекать при низких и даже отрицательных температурах. Cu toate acestea, rata de descompunere a monomerilor la radicali sub acțiunea razelor UV sau a radiației vizibile (VI) este scăzută. Pentru accelerarea polimerizării fotochimice sunt utilizate două metode: 1. Introducerea în substanțele monomer - fotoinitiatoare 2. Introduceți în substanțele monomer - fotosensibilizatori. Photoinitiatorii sunt substanțe care, sub influența energiei fotonice, radiațiile UV sau VI se descompun mai ușor în radicali decât monomerii înșiși. Photoinitiatorii sunt haloalchili (tetraclorura de carbon CCI4, 1,2-tricloretanC2CI6), compuși organometalici. Mecanismul de acțiune al CCI4 este după cum urmează: Photosensitizers - sunt substanțe care absorb și acumulează energia razelor UV sau VI - radiația într-o gamă mai largă de lungimi de undă decât monomer, atunci o valoare mai mare este dat la monomer porțiuni de energie acumulată. Moleculele monomerului intră repede într-o stare excitată și se descompun în radicali. Rolul jucat de substanțe fotosensibilizatori care conțin în structura lor o legătură conjugată dublă (grupe cromofore) sau cicluri aromatice, de exemplu, fluoresceina sau dibenzfenon Mecanismul de acțiune al fotosensibilizatorilor (Φ) este după cum urmează: Φ + hn Φ * Φ * + Μ Φ + Μ * Μ * Μ + M · Tabelul 11 - Grupuri majore de inițiatori de polimerizare radicală, mecanismul și condițiile de degradare a acestora Inițiator - polimerizare - o enciclopedie mare de petrol și gaze, articol, pagina 1 Operații radicale asupra plămânilor, operații pe organele din piept și cavitatea toracică
Articole similare
Trimiteți-le prietenilor: