Capacitatea termică a unui sistem (sau a corpurilor) este raportul dintre cantitatea de căldură raportată sistemului și creșterea temperaturii observată în acest caz (în absența unei reacții chimice, treceri ale materiei de la o stare agregată la alta).
Căldura specifică este proporțională cu cantitatea de materie. Distingeți între capacitatea de căldură specifică și molară.
Heat specific Curtea este cantitatea de căldură necesară pentru a încălzi o unitate de masă a unei substanțe cu 1 K. Unitatea de măsură pentru căldura specifică este J / (g × K).
Capacitatea de căldură molară C este cantitatea de căldură necesară pentru încălzirea a 1 mol de substanță per 1 K. Unitatea de măsură a capacității de încălzire molară este J / (mol × K).
Căldura molară și specifică este legată de relația:
,
unde M este masa molară.
Există capacități de căldură medii și reale.
Capacitatea medie de căldură este determinată de raportul dintre sistemul de încălzire raportat și creșterea observată a temperaturii:
Capacitatea reală de căldură C corespunde unei modificări infinitezimale a temperaturii:
Este ușor de stabilit o conexiune între încălzirea specifică medie și adevărată, integrând (1.8) în intervalul de temperatură de la T1 la T2 și înlocuind expresia obținută cu Q în (1.7):
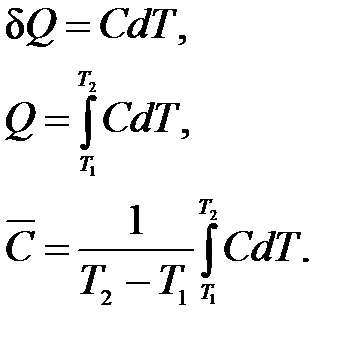
În funcție de condițiile în care se efectuează încălzirea, se distingă capacitatea de încălzire la volumul constant CV (capacitatea de încălzire izocorică) și capacitatea de încălzire la presiune constantă Cp (capacitatea de încălzire izobarică):
Dacă încălzirea are loc la V = const. toată căldura duce la creșterea energiei interne; la p = const, în plus față de creșterea energiei interne, se efectuează lucrările de expansiune.
Dacă constanta volumului sau presiunii este specificată, derivatul parțial din punctul 1.9 este înlocuit cu derivatul total:
Integrarea expresiilor (1.10) în intervalul de temperatură de la T1 la T2. și presupunând că Cp și CV în intervalul de temperatură indicat sunt constante, obținem:
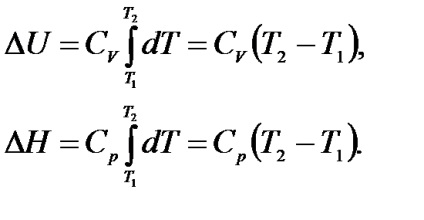
Se stabilește relația dintre Cp și CV pentru 1 mol de gaz ideal. În conformitate cu ecuația lui Mendeleev-Clapeyron (1.1)
.
Capacitățile de căldură izoborice și izocorice ale unui gaz ideal diferă de valoarea constantei de gaz universal R.
Pentru un gaz ideal monatomic
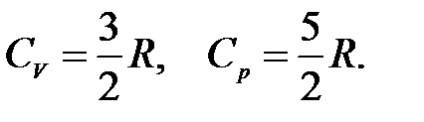
Pentru un gaz ideal diatomic la temperaturi medii
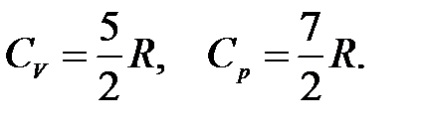
Capacitățile de căldură izoborice și izocorice ale solidelor sunt practic egale.
Capacitatea de căldură a corpurilor solide, lichide și gazoase depinde de temperatură. Dependența capacității termice a substanțelor individuale asupra temperaturii este cel mai adesea exprimată printr-o ecuație empirică a formei:
unde a. b. c. c "sunt coeficienți empirici calculați pe baza datelor experimentale.
Pentru substanțele organice, coeficientul c '= 0, pentru anorganic - c = 0.
Această ecuație empirică este aplicabilă numai într-un anumit interval de temperatură. Prin urmare, coeficienții a, b, c și c 'nu au niciun sens fizic. Pentru multe substanțe, acestea sunt enumerate în manuale (indicând intervalul de temperatură în care pot fi utilizate).
1.3.3 Efectul temperaturii asupra efectului termic
reacție chimică. Ecuația lui Kirchhoff
Temperatura are o mare influență asupra efectelor termice ale reacțiilor chimice. Să stabilim problema cantitativ pentru a caracteriza această influență.
Luați în considerare reacția chimică care are loc la p = const:
.
Lăsați entalpia substanțelor inițiale care participă la reacție să fie egală cu H1. iar entalpia produselor de reacție este H2. atunci
unde este capacitatea de încălzire a sistemului în starea inițială:
.
În mod similar, pentru produsele de reacție:
.
Ecuația scăzând (1.12) pe termen din ecuația (1.13), obținem:
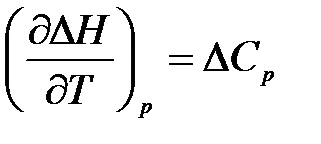
Pentru reacția chimică este
.
În mod similar, pentru procesele care apar la V = const,
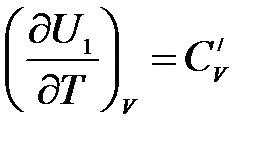
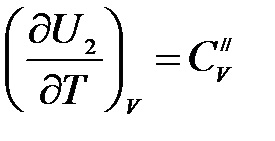
Pentru o reacție chimică
.
Ecuațiile rezultate (1.13), (1.14) exprimă legea lui Kirchhoff:
Coeficientul de temperatură al efectului cald al reacției chimice (sau al altor procese) care apare la p = const sau V = const este egal cu diferența dintre încălzirea sistemului în stările inițiale și finale.
Să analizăm ecuațiile lui Kirchhoff.
Rezultă din ecuațiile că efectul temperaturii asupra efectului termic este determinat de semnul cantității:
- dacă # 916; Cp> 0, apoi derivatul
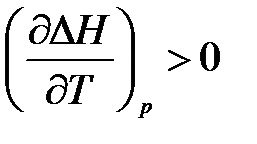
- dacă # 916; <0, то производная
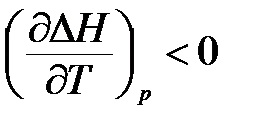
- dacă # 916; Cp = 0, atunci efectul termic al reacției este independent de temperatură.
Legea lui Kirchhoff ne permite să calculam efectele termice ale reacției la orice temperatură.
Obținem o ecuație pentru calculul efectului termic care apare atunci când
p = const. Împărțim variabilele în ecuația lui Kirchhoff:
.
La integrarea ecuației Kirchhoff, dependența de temperatură a capacității termice este adesea folosită sub formă de serii de putere care sunt valabile într-un anumit interval de temperatură. In majoritatea cazurilor, integrarea este realizată în anumite limite, luând limita inferioară a temperaturii de integrare 298 K, în timp ce pentru partea de sus - temperatura T. Căldura de reacție la 298 K poate fi calculată cu ușurință folosind prima sau a doua lege a investigației Hess. Ca urmare a integrării, obținem:
Deoarece capacitatea de căldură izobarică are proprietățile funcției de stare, pentru # 916; Cp poate fi scris:
,
,
,
,
.
Înlocuirea expresiei pentru # 916; Cp în (1.15) și integrarea, obținem:
.
Dacă intervalul de temperaturi de la 298 K la T unul dintre reactanți suferă o schimbare de stare agregată, adică transformare de fază are loc, în intervalul de temperatură este împărțit în două intervale: de la 298 K la Tf.p. (temperatura la care are loc tranziția de fază) și de la T.P. la T:
.
Calcularea efectului termic prin ecuația Kirchhoff este foarte simplificată dacă folosim capacitatea medie de căldură pentru reactivi sau presupunem că nu depinde de temperatura într-un interval dat.
Reducem ecuația (1.16) la formular
.
Expresia cuprinsă în paranteze este întotdeauna constantă, deci în acest caz, dependența efectului termic asupra temperaturii este liniară. Dezavantajul acestei metode de calcul al efectelor termice constă în precizia sa scăzută.
Articole similare
Trimiteți-le prietenilor: