O reacție chimică apare atunci când o legătură este ruptă și se formează altele. Cursul acestei sau acelei reacții este determinat de câțiva factori, dintre care principalele sunt natura moleculelor (reactanților) și a reactivilor care atacă, temperatura, concentrația componentelor, catalizatorul. Important pentru determinarea mecanismului reacției aparține naturii particulelor (intermediar), care se formează în etapele intermediare ale scindării legăturii chimice.
Disocierea legăturii covalente $ C-X $ poate avea loc în trei scheme principale (Figura 1).
Ca urmare a ruperii legăturii heterolitice, are loc o deplasare completă a perechii de electroni la un atom, cu formarea ionilor de carbon corespunzători, carbanioni sau carbocații. Atunci când legătura este hemolitică, se formează radicali liberi.
Natura, formarea și stabilitatea particulelor intermediare
Ioniții organici și radicalii sunt principalii intermediari ai majorității reacțiilor și prezintă reactivitate semnificativă și acționează ca reactivi.
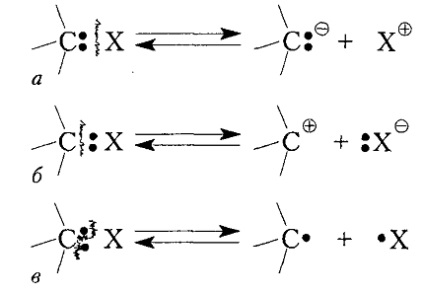
Figura 1. Disocierea legăturii $ C-X $ cu formarea: a - carbanion, b - carbocare și b - radical; a și b - divizarea heterolitică (ionică), β - hemolitică (radicală)
carbocationilor
Carbocația are o sarcină totală pozitivă ($ + I $) pe atomul de carbon, care este într-o stare hibridă. Prin urmare, structura carcasei este plată, iar cele trei orbite hibride sunt situate în același plan la unghiuri de 120 $. Vacanta $ p-AO $ este localizata perpendicular pe acest plan.
Formarea carbocazilor. Există mai multe metode de formare a carbocazilor. Cele mai importante sunt:
- Adăugarea unui proton la anumiți compuși, printre care, în primul rând, hidrocarburile nesaturate și alcoolii.
- Ionizarea directă a legăturii polare $ C-X $ sub acțiunea mediului extern. Această disociere a legăturii, pe lângă polaritatea proprie, este facilitată de prezența unui solvent polar sau a unui catalizator, de exemplu, acizii Lewis
- În izomerizarea catalitică a alcanilor și acțiunea pe alcani a superacidelor cum ar fi un complex de acid fluorosulfonic - pentafluorantimonat.
Stabilitatea carbocazelor
Este cunoscut faptul că scindarea heterolitice energiei de $ C-X $ pentru a forma carbocationului (fig. 1, b) este suficient de mare și în faza gazoasă este, de exemplu, alcani, 900-1300 kJ / mol. Ca rezultat, carbocatiile nu sunt foarte stabile, au o reactivitate semnificativa. Stabilitatea carbococării este mai mare, cu atât mai mult a fost delocalizată sarcina pozitivă. Alchil substituenții stabilizează carbocarea cu proprietățile lor donatoare, contribuie la reducerea deficienței de electroni pe un atom de carbon cu o sarcină pozitivă. Înlocuitorii cu efect negativ $ I ^ - $ destabilizează carbocitarea și devine mai puțin stabil.
Rezolvați controlul la toate subiectele. 10 ani de experiență! Prețul este de la 100 de ruble. termen de la 1 zi!
Cu toate acestea, de inducție și giperkonyugatsionnye efectele substituenților prezintă relativ slabe de stabilizare factori carbocationilor, în afară de acest efect este în mare parte dispar atunci când eliminați deputatul din $ gratuit p-AO $. Cea mai mare influență asupra stabilității carbocationilor produce efectul mezomeric legăturilor nesaturate prin conjugare liber $ p-AO $ cu $ \ pi $ -bond, situat în $ \ alpha $ orbitalii la poziția respectivă
Stabilizarea carbocazelor poate fi de asemenea realizată prin conjugarea unui centru de carbocare vacant $ p-AO $ cu o pereche ne-împărțită de electroni ai heteroatomului (conjugare $ p-p):
Figura 2. Stabilitatea radicalilor alchil
Într-o mare măsură, stabilitatea carbocazelor este afectată de solvent. În medii polare, un cation poate exista într-o stare liberă ca urmare a interacțiunii sale de solvatare cu molecule de solvent. În mediul nepolar, poate exista ca o pereche de ioni cu un contraion. În unele cazuri, carbocaziile pot fi atât de stabile încât există sub formă de săruri normale. De exemplu, cationul trifenilmetil în condiții normale este o sare.
Rezolvați controlul la toate subiectele. 10 ani de experiență! Prețul este de la 100 de ruble. termen de la 1 zi!
carbanionilor
Atunci când o pereche de electroni neparticipați este plasată pe un atom de carbon, apar intermediari, numiți carbanioni. Ei au o structură plană sau piramidală și o pereche de electroni nedivizuiți se află pe orbita atomică sau hibridizată. Astfel, pentru compușii saturați, configurația piramidală sau tetraedrică este caracteristică, similară configurației compușilor de azot trivalent. O pereche de electroni împărțită în anionul metil ocupă sph-hibridul orbital. Se crede că configurația piramidală a carbanionilor este caracterizată printr-o inversare rapidă a tetraedrului, similar cu efectul unei "umbrelă inversată" în compușii $ NR_3 $.
O structură plat este caracteristică atunci când poziția $ \ alpha $ este localizată în centrul anionic al conexiunii $ \ pi $, de exemplu, pentru anionul alil.
Atunci când locația unui centru anionic la atomul de carbon direct cu perechea nesaturare electron unshared situat la orbitalii hibridizate corespunzătoare ($ sp2- $ sau $ SP-$) și nu schimbă starea de hibridizare, de exemplu, în cazul de vinil și etinil anion-anion.
Pregătirea carbanionilor
Una dintre metodele cunoscute de formare a carbanionilor este interacțiunea metalelor cu halogenuri de alchil, de exemplu:
Figura 3. Stabilitatea radicalilor alchil
Rezolvați controlul la toate subiectele. 10 ani de experiență! Prețul este de la 100 de ruble. termen de la 1 zi!
Vom scrie ieftin și la timp! Peste 50 000 de specialiști dovediți
Comunicare $ C-Li $ foarte polar (ionicity ajunge la aproximativ $ 43 \% $), iar conexiunea este prezentă sub forma unei metil anion perechi de ioni și cationi de litiu ($ CH_3 \ cdot Li + $). Nu trebuie uitat că o astfel de înregistrare este arbitrară, deoarece suma de 57 $ \% $ a obligațiunii $ C-Li $ aparține componentei covalente.
O altă metodă de carbanion este obținută prin interacțiunea compușilor cu legături puternice polar ($ C-Hs-acid) și reactivi cu proprietățile de bază:
Figura 4. Stabilitatea radicalilor alchil
Stabilitatea carbanionilor
Carbanioni Stabilitatea depinde de delocalizarea sarcină negativă și poate fi variat atunci când sunt plasate în $ \ alpha $ substituentului poziția de retragere a centrului anion de electroni cu un efect negativ sau substituenti cu $ \ pi $ -bond, care prezintă M-efect negativ. Manifestare efect mezomeric constă în orbital conjugare $ \ pi $ -bond molecular cu perechea deconectat orbitală unshared electroni de atomi de carbon ($ P- \ pi $ -conjugate). Stabilizarea anionului acetonilic poate fi reprezentată și prin intermediul structurilor rezonante:
Rezolvați controlul la toate subiectele. 10 ani de experiență! Prețul este de la 100 de ruble. termen de la 1 zi!
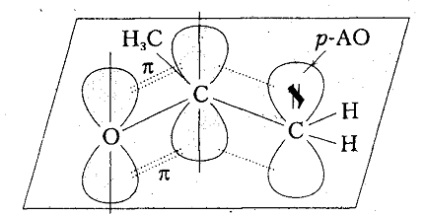
Figura 5. Stabilitatea radicalilor alchil
Atunci când un heteroatom (oxigen) este plasat într-un fragment nesaturat cu o electronegativitate mai mare decât carbonul, o parte semnificativă din sarcina negativă este acumulată pe heteroatom.
Chiar mai stabilă este stabilitatea carbanionilor sub influența unui sistem aromatic, de exemplu pentru un anion al ciclopentadienilului:
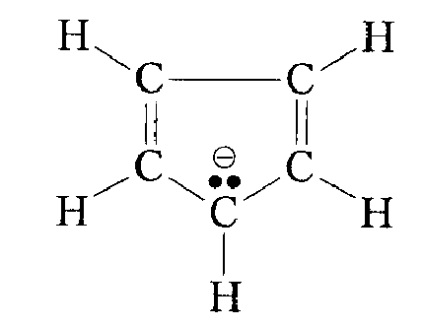
Figura 6. Stabilitatea radicalilor alchil
În plus, stabilitatea carbanionilor depinde de natura hibridizării atomului de carbon. Cu cât este mai mare contribuția lui $ x-AO $ la starea hibridă, cu atât mai stabile sunt carbanionii, adică stabilitatea lor în seria $ sp3
Influența factorilor structurali asupra stabilității anionilor are o direcție inversă în comparație cu cationii. În special, stabilitatea carbanionilor scade după cum urmează: primar> secundar> terțiar.
Articole similare
Trimiteți-le prietenilor: