În Fig. Figura 52 prezintă izotermele Van der Waals.
La temperaturi foarte ridicate au o formă aproape de hiperbola; aceste izoterme caracterizează starea gazoasă a substanței (gaz aproape ideal). Pe măsură ce temperatura scade, forma isothermului se schimbă și la o anumită temperatură (critică), detectează punctul de inflexiune al curbei. La temperaturi mai joase (subcritice) izotermă în locul porțiunii orizontale corespunzătoare lichidului de tranziție de fază - vapori, au o porțiune ondulată (Fig 53.).
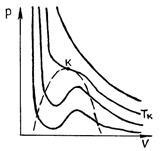
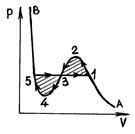
P și p. 52 R și p. 53
Măsurătorile arată că substanța reală izotermelor coincide în mod substanțial cu izotermei de forțe van der Waals în zonele (stare gazoasă) și (lichefieze). Cu toate acestea, în loc în mijlocul porțiunii orizontale 51 care corespunde tranziției de fază a lichidului - izoterma vaporilor Van der Waals are o porțiune ondulată. Această regiune asemănătoare valurilor este caracterizată după cum urmează. Plot 12 corespunde unei stari metastabile de abur (abur saturat), o porțiune de 54 - ca lichid metastabil (supraîncălzit lichid). La punctul 1 există numai vapori saturați, iar la punctul 5 doar lichid fierbinte. În ceea ce privește porțiunea de undă 234, este irealizabilă fizic, deoarece substanțele naturale pentru care, la o creștere a temperaturii constante ar duce la o creștere a presiunii. Acesta din urmă este posibil numai dacă temperatura din această secțiune nu este constantă. Vaporii suprasaturată (porțiunea 12) - stare gazoasă a materiei în care presiunea p este mai mare decât presiunea de vapori saturați la o temperatură dată - pot fi obținute experimental prin comprimarea gazului de purjare la o presiune mai mare decât presiunea de vapori saturați, și nu se va condensa. Condiția vaporilor suprasaturată, deși are o anumită stabilitate, dar este mai puțin stabil decât statul în două faze (izobară 135), în care, după cum știm, o parte din substanța este în formă lichidă, și o parte - sub formă de abur saturat. Prin urmare, pentru un efect extern mic, vaporii suprasaturați trec parțial în lichid, iar vaporii rămași devin saturați.
Supraîncălzit fluid (secțiunea 45), - o stare caracterizată prin faptul că există la o presiune mai mică decât presiunea de vapori la o temperatură dată - poate fi obținut prin prelungit fierberea lichidului pur, care rezultă din bulele de gaz lichefiat îndepărtate (centre de vaporizare) și Lichidul este încălzit la o temperatură deasupra punctului de fierbere la această presiune. Starea lichidului supraîncălzit este de asemenea mai puțin stabilă decât starea de echilibru dintre vapori lichizi și saturați. Dacă particule de substanță străină sunt introduse într-un astfel de lichid supraîncălzit, atunci are loc o tranziție rapidă la o stare în două faze.
Stările de vapori suprasaturați și lichidul supraîncălzit sunt utilizate în dispozitivele de fizică nucleară (camera Wilson și camera cu bule) pentru înregistrarea și măsurarea parametrilor particulelor elementare.
Dacă Izoterma Van der Waals porțiune ondulator pentru a înlocui o linie orizontală 135, atunci izoterma se obține ca va fi calitativ corect descrie și materialul de stat în două faze. Poziția acestei linii poate fi determinată în cazul în care un ciclu reversibil 1234531 doua lege a închis al termodinamicii aplicat la Clausius înregistrare (2.13.7):
Deoarece de-a lungul temperaturii mod 1234531 a substanței rămâne aceeași (deoarece această cale este alcătuită din secțiuni din două variante posibile ale aceluiași izoterma), ultima ecuație poate fi scrisă ca
Substituind în această relație valoarea de la prima lege a termodinamicii și ținând seama de aceasta
obținem pentru ciclul examinat:
Realizăm cu ultima egalitate transformările evidente
adică linia orizontală 135 trebuie să fie trasă astfel încât liniile umbrite din Fig. 53 de zone au fost egale.
Așa cum am arătat deja, în punctul critic izotermul are o tangență și o inflexiune, deci la acest moment relațiile trebuie să aibă
unde notația înseamnă că derivatele corespunzătoare sunt calculate pentru valorile parametrilor de material egali cu valoarea critică. Scriind ecuația lui Van der Waals în formă
apoi calcularea derivatelor și, echivalând-le cu zero, nu este dificil de obținut
Din expresiile (3.6.8-3.6.10) rezultă această relație
nu depinde de natura substanței. Experimentul arată că valorile au valori diferite pentru diferite gaze: pentru hidrogen este 0,33, pentru oxigenul 0,29, pentru dioxidul de carbon 0,22. Aceste valori diferențe semnificative și datele experimentale arată că Van der Waals, din care se obține această valoare aproximativă o, deși calitatea imaginii se schimbă de stare a materiei este transmis de ecuația destul de bine. Un număr mare de încercări sunt făcute pentru a obține o ecuație mai exactă a stării materiei. Cu toate acestea, aceste ecuații conțin un număr mare de coeficienți de corecție, a căror semnificație fizică este neclară, ca în ecuația lui van der Waals.
În forma cea mai generală, prin metodele fizicii statistice, academicianul NN Bogolyubov a obținut ecuația de stat
unde sunt așa-numitele coeficienți viriali, care sunt funcții numai de temperatură. Din ecuația Bogolyubov rezultă că cu cât este mai mare valoarea volumului molar. cei mai puțini membri ai seriei ar trebui luați în considerare pentru a obține un rezultat suficient de precis. Toți termenii din seria de putere dispar și ecuația (3.6.12) ia forma. așa cum era de așteptat, ecuația lui Bogolyubov se transformă în ecuația lui Mendeleev-Clapeyron. Coeficienții viriali nu pot fi calculați prin metode pur teoretice și, prin urmare, trebuie determinate prin intermediul unor date experimentale. Cu toate acestea, această problemă se dovedește a fi atât de complicată încât este mai avantajos să se obțină ecuația de stare pur și simplu sub forma unei formule de interpolare care descrie datele experimentale.
Articole similare
Trimiteți-le prietenilor: