Substanțele conținând una sau mai multe grupări carboxil în moleculă se numesc acizi carboxilici.
O
//
Un grup de atomi-C este numit o grupare carboxil sau o grupare carboxil.
# 92;
OH
Acizi organici care conțin o grupă carboxil în moleculă sunt monobazici. Formula generală pentru acești acizi este RCOOH.
Acizii carboxilici care conțin două grupări carboxil sunt numiți dibazici. Acestea includ, de exemplu, acizii oxalici și succinici.
Există, de asemenea, acizi carboxilici multi-bazici care conțin mai mult de două grupări carboxil. Acestea includ, de exemplu, acidul citric tribazic. În funcție de natura radicalului de hidrocarbură, acizii carboxilici sunt împărțiți în limitați, nesaturați, aromatici.
Acizii carboxilici limitați sau saturați sunt, de exemplu, acidul propanoic (propionic) sau acidul succinic deja cunoscut.
Nomenclatură și izomerism
carboxilic format din numele titlului alcan (alean având același număr de atomi de carbon în moleculă) cu adăugarea de sufix Male, închidere cuvânt și acid corespunzător -lea. Numerotarea atomilor de carbon începe cu gruparea carboxil. De exemplu:
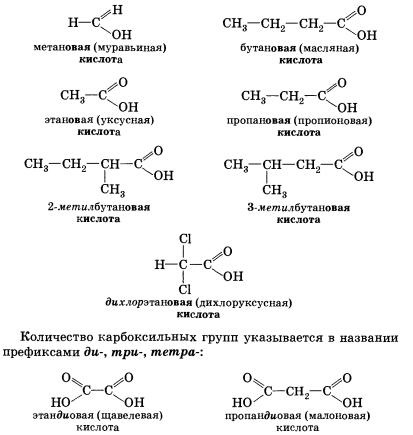
Mulți acizi au format din punct de vedere istoric nume sau trivial (Tabelul 6).
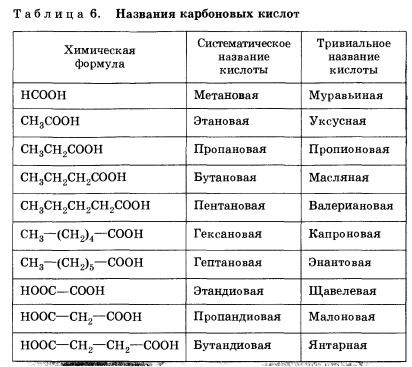
Compoziția acizilor monobazici limitați va fi reflectată de formula generală CnH2n02, sau CnH2n + 1COOH sau RCOOH.
Proprietățile fizice ale acizilor carboxilici monobazici limitați
Acizi inferiori, de exemplu, acizi având o moleculă cu greutate moleculară relativ mică care conține până la patru atomi de carbon, - .. Un lichid cu un miros caracteristic înțepător (amintesc miros de acid acetic). Acizii conținând 4 până la 9 atomi de carbon sunt lichide uleioase vâscoase cu un miros neplăcut; conținând mai mult de 9 atomi de carbon în moleculă - solide care nu se dizolvă în apă. Punctele de fierbere ale acizilor carboxilici monobazici limitați cresc cu numărul de atomi de carbon din moleculă și, în consecință, cu creșterea greutății moleculare relative. De exemplu, punctul de fierbere al acidului formic este 101 ° C, acetic - 118 ° C, propionic - 141 ° C.
Cel mai simplu acid carboxilic este HCOOH formic. având o greutate moleculară relativă mică (46), în condiții obișnuite este un lichid cu punct de fierbere de 100,8 ° C În același timp, butanul (MR (C4H10) = 58) este gazos în aceleași condiții și are un punct de fierbere de -0,5 ° C. Această discrepanță între punctul de fierbere și masa moleculară relativă se datorează formării de dimeri de acizi carboxilici în care două molecule de acid sunt legate prin două legături de hidrogen. Apariția legăturilor de hidrogen devine clară atunci când se ia în considerare structura moleculelor de acid carboxilic.
Acizii formici și acetic sunt solubili în apă fără limită. Evident, pe măsură ce crește numărul atomilor dintr-un radical hidrocarbonat, solubilitatea acizilor carboxilici scade.
Proprietățile generale caracteristice clasei de acizi (atât organice cât și anorganice) se datorează prezenței în molecule a unei grupe hidroxil conținând o legătură puternic polară între atomii de hidrogen și oxigen.
1. Disociere cu formarea de cationi de hidrogen și anioni ai reziduului acid.
Echilibrul disocierii acizilor carboxilici este deplasat spre stânga, majoritatea covârșitoare a acestora sunt electroliți slabi. Cu toate acestea, gustul acid, de exemplu, acidul formic și acidul acetic se explică prin disocierea în cationi de hidrogen și anioni ai resturilor acide.
În mod evident, prezența hidrogenului "acid" în moleculele de acid carboxilic, adică hidrogenul grupării carboxil, cauzează, de asemenea, alte proprietăți caracteristice.
2. Interacțiunea cu metalele din seriile electrochimice de tensiuni până la hidrogen. Deci, fierul restabilește hidrogenul din acidul acetic:
2CH3-COOH + Fe -> (CHgCOO) 2Fe + H2
3. Interacțiunea cu oxizi de bază cu formarea de sare și apă:
2R-COOH + CaO -> (R-COO) 2Ca + H20
4. Interacțiunea cu hidroxizi metalici pentru a forma sare și apă (reacție de neutralizare):
R-COOH + NaOH-> R-COONa + H20 3R-COOH + Ca (OH) 2 -> (R-COO) 2Ca + 2H20
5. Interacțiunea cu sărurile acizilor mai slabi, cu formarea acestora din urmă. Astfel, acidul acetic înlocuiește stearatul din stearatul de sodiu și carbonul din carbonatul de potasiu.
6. Interacțiunea acizilor carboxilici cu alcooli cu formarea de esteri este deja cunoscută de reacția de eterificare (una dintre cele mai importante reacții caracteristice acizilor carboxilici). Interacțiunea dintre acizii carboxilici și alcoolii este catalizată de cationi de hidrogen.
Reacția de esterificare este reversibilă. Echilibrul se deplasează spre formarea esterului în prezența agenților de îndepărtare a apei și îndepărtarea esterului din amestecul de reacție.
În reacție se formează esterificarea inversă, care se numește hidroliza esterului (reacția esterului cu apa), acidul și alcoolul. Evident, alcoolii polihidrici, de exemplu glicerolul, pot reacționa cu acizii carboxilici, adică intra într-o reacție de esterificare:
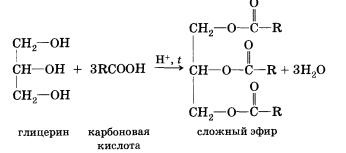
Toți acizii carboxilici (cu excepția formicului) împreună cu gruparea carboxil conțin un rest de hidrocarbură în molecule. Desigur, acest lucru nu poate afecta decât proprietățile acizilor, determinate de caracterul reziduurilor de hidrocarburi.
7. Reacții de adiție pe o legătură multiplă - în ele se găsesc acizi carboxilici nesaturați; de exemplu, reacția de hidrogenare este hidrogenarea. Când se hidrogenizează acidul oleic, se formează acidul stearic limitator.
Acizii carboxilici nesaturați, ca și alți compuși nesaturați, atașează halogeni printr-o dublă legătură. De exemplu, acidul acrilic decolorizează apa de brom.
8. Reacțiile de substituție (cu halogeni) - limita de acizi carboxilici pot intra în ea; de exemplu, în reacția dintre acidul acetic și clor, pot fi obținuți diferiți clor-derivați:
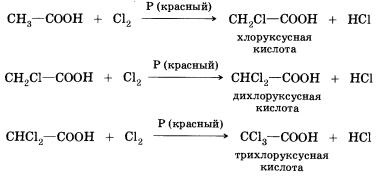
Când se halogenă acizi carboxilici care conțin mai mult de un atom de carbon în restul de hidrocarbură, este posibil să se formeze produse cu poziții diferite de halogen în moleculă. Atunci când reacția se desfășoară printr-un mecanism de radical liber, toți atomii de hidrogen din restul de hidrocarbură pot fi înlocuiți. Dacă reacția este efectuată în prezența unor cantități mici de fosfor roșu. apoi merge selectiv - hidrogenul este înlocuit numai în poziția a (în apropierea celui mai apropiat de grupul funcțional al atomului de carbon) în molecula de acid. Motivele acestei selectivități veți învăța atunci când studiați chimia într-o instituție de învățământ superior.
Acizii carboxilici formează diferiți derivați funcționali la substituția grupării hidroxil. Când acești derivați sunt hidrolizați, acidul carboxilic este din nou format din ele.
Acizii carboxilici pot fi obținuți prin oxidarea alcoolilor primari și a aldehidelor.
Acizii carboxilici aromatici se formează în timpul oxidării de omologi ai benzenului.
Hidroliza diferitelor derivați de acid carboxilic are ca rezultat, de asemenea, producerea de acizi. Astfel, în hidroliza esterului se formează alcoolul și acidul carboxilic. Așa cum s-a menționat deja mai sus, reacțiile de esterificare și hidroliză, catalizate cu acid, sunt reversibile. Hidroliza esterului sub acțiunea unei soluții apoase de alcalii are loc ireversibil, în acest caz se formează un acid din ester, dar sarea acestuia. Când se hidrolizează nitrilii, se formează mai întâi amide, care apoi sunt transformate în acizi. Acizii carbonici se formează prin interacțiunea compușilor magneziu-organici cu monoxidul de carbon (IV).
Reprezentanți individuali ai acizilor carboxilici și semnificația lor
Acidul acid formic (metan) HCOOH este un lichid cu un miros ascuțit și un punct de fierbere de 100,8 ° C, este foarte solubil în apă. Acidul formic este otrăvit, dacă devine pe piele provoacă arsuri! Lichidul stinging emis de furnici conține acest acid. Acidul formic are o proprietate dezinfectantă și, prin urmare, își găsește aplicarea în industria alimentară, din piele și farmaceutică, medicină. Se folosește și pentru vopsirea țesăturilor și a hârtiei.
Acid acetic (etanoic) CH3COOH - lichid incolor cu miros caracteristic ascuțit, amestecat cu apă în orice raport. Soluțiile apoase de acid acetic sunt comercializate sub denumirea de oțet (soluție 3-5%) și oțet (soluție 70-80%) și este utilizat pe scară largă în industria alimentară. Acidul acetic este un solvent bun pentru multe substanțe organice și, prin urmare, este utilizat în vopsirea, fabricarea pielii și în industria vopselelor și lacurilor. În plus, acidul acetic este materia primă pentru producerea multor compuși organici din punct de vedere tehnic: de exemplu, substanțele pe bază de buruieni sunt folosite pentru combaterea buruienilor, - erbicide.
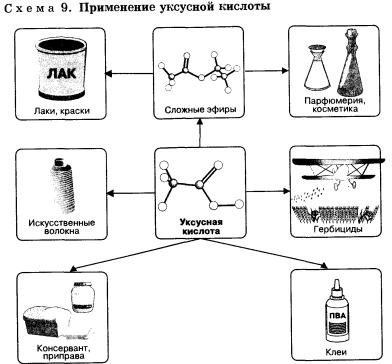
Acidul acetic este componenta principală a oțetului de vin, mirosul caracteristic al acestuia se datorează. Este un produs al oxidării etanolului și este format din acesta când vinul este depozitat în aer.
Cei mai importanți reprezentanți ai acizilor monobazici cu limitare superioară sunt C15H31COOH palmitic și acidul stearic C17H35COOH. Spre deosebire de acizii inferiori, aceste substanțe sunt solide, slab solubile în apă.
Cu toate acestea, sărurile lor - stearatul și palmitatul - sunt foarte solubile și au un efect de detergent, deci se mai numesc și săpunuri. Este clar că aceste substanțe sunt produse la scară largă.
Dintre acizii carboxilici nesaturați mai mari, acidul oleic C17H33COOH sau (CH2) 7COOH are o importanță majoră. Este un lichid asemănător cu ulei, fără gust și miros. O aplicație largă în tehnologie își găsește sărurile sale.
Cel mai simplu reprezentant al acizilor carboxilici dibazici este HOOC-COOH acid oxalic (etandioic), sărurile căruia se găsesc în multe plante, de exemplu în sorrel și acid. Acidul oxalic este o substanță cristalină incoloră care se dizolvă bine în apă. Se folosește pentru lustruirea metalelor, în industria prelucrării lemnului și a pielăriei.
1. Acidul elaidic nesaturat C17H33COOH este un izomer trans al acidului oleic. Faceți o formulă structurală pentru această substanță.
2. Scrieți ecuația reacției de hidrogenare a acidului oleic. Denumiți produsul acestei reacții.
3. Scrieți ecuația reacției de combustie a acidului stearic. Ce volum de oxigen și aer (nu) este necesar pentru a arde 568 g de acid stearic?
4. Un amestec de acizi grași solizi - palmitic și stearic - se numește stearină (din aceasta se fac lumanari stearice).
Ce volum de aer (nu) este necesar pentru a arde o lumânare stearică de două sute grame dacă stearina conține acizi palmitic și stearici egali? Ce volum de dioxid de carbon (nu) și masa de apă se formează în acest caz?
5. Rezolvați problema anterioară, cu condiția ca lumânarea să conțină cantități egale (număr egal de moli) de acizi stearici și palmiți.
6. Pentru a îndepărta petele de rugină, acestea sunt tratate cu o soluție de acid acetic. Efectuați ecuațiile moleculare și ionice ale reacțiilor care au loc, luând în considerare că rugina conține oxid de fier (III) și hidroxid - Fe2O3 și Fe (OH) 3.
De ce nu sunt îndepărtate aceste pete de apă? De ce dispar atunci când sunt tratați cu o soluție acidă?
7. Sodul alimentar (băuturi) MHC03 adăugat la aluatul azimut este "stins" cu acid acetic. Faceți această reacție la domiciliu și completați ecuația sa, știind că acidul carbonic este mai slab decât oțetul. Explicați formarea spumei.
8. Cunoașterea faptului că clorul este mai mult electronegativ decât carbonul. localizați următorii acizi: acetic, propionic, cloroacetic, dicloracetic și acizi tricloracetici pentru a îmbunătăți proprietățile de aciditate. Justificați rezultatul.
9. Cum explici că acidul formic vine în reacția unei "oglinzi de argint"? Scrieți ecuația pentru această reacție. Ce gaz poate fi eliberat în acest caz?
10. Când 3 g acid carboxilic monobazic limitativ au reacționat cu un exces de magneziu, s-au eliberat 560 ml (n.o.) de hidrogen. Determinați formula acidă.
11. Dați ecuațiile de reacție, cu care puteți descrie proprietățile chimice ale acidului acetic. Denumiți produsele acestor reacții.
12. Oferiți o metodă simplă de laborator, cu care să puteți recunoaște propanul și acizii acrilici.
13. Scrieți ecuația reacției pentru prepararea esterului metilic al metanolului și acidului formic. În ce condiții ar trebui să se efectueze această reacție?
14. Se compun formule structurale pentru substanțele având compoziția C3H602. Ce clase de substanțe le pot fi atribuite? Dați ecuațiile reacțiilor caracteristice fiecăruia dintre ele.
15. Substanța A - izomerul acidului acetic - nu se dizolvă în apă, dar poate fi hidrolizată. Care este formula structurală a substanței A? Denumiți produsele hidrolizei sale.
16. Formați formulele structurale pentru următoarele substanțe: a) acetat de metil; b) acid oxalic;
c) acid formic; d) acid dicloroacetic; e) acetat de magneziu; e) acetat de etil; g) formiat de etil; h) acid acrilic.
17 *. O probă a acidului organic monobazic limitativ cu o masă de 3,7 g a fost neutralizată cu o soluție apoasă de bicarbonat de sodiu. Când trec gazul degajat prin apa de var, se obțin 5,0 g de precipitat. Ce fel de acid a fost luat și care este volumul gazului eliberat?
Articole similare
Trimiteți-le prietenilor: