SECȚIUNEA I. CHIMIE GENERALĂ
2. Structura atomului
2.4. Electron. Straturile electronice
Teoria modernă a structurii electronice a unui atom se bazează pe o secțiune importantă a fizicii - mecanica cuantică, care descrie proprietățile obiectelor microscopice.
Conform conceptelor de mecanică cuantică, electronul ca microparticol are o natură duală: prezintă proprietățile unei particule și a unui val. Traiectoria mișcării sale este luată în considerare, dar numai probabilitatea de a găsi în spațiu în jurul nucleului. Spațiul din jurul nucleului, în care cel mai probabil (
90%) este un electron, numit orbital. Fiecare electron dintr-un atom ocupă un orbital definit și formează un nor de electroni. Un nor electronic este o colecție de poziții diferite ale unui electron care este în mișcare constantă.
Din punct de vedere grafic, orbitele sunt reprezentate sub forma unei celule, numită și celula cuantică, iar electronii care sunt plasați pe orbital sunt arătați prin săgeți. Fiecare orbital poate avea unul sau (cel mult) doi electroni cu caracteristici cuantice diferite - spin 1 (principiul excluziunii Pauli).
Acești doi electroni, având spinări opuse, sunt desemnați în celulă prin săgeți îndreptate opus. Astfel de electroni se numesc perechi. Dacă pe orbital există un electron, se numește nepereche și este notat cu
Cea mai importantă caracteristică a unui electron (atunci când se ia în considerare proprietățile sale în chimie) este energia. Electronii care au același nivel de energie sau același nivel de energie se deplasează de-a lungul unor orbite aproape de dimensiune, formează niveluri de energie (straturi electronice, cochilii electronice). ele sunt numerotate pornind de la miez: 1, 2, 3, 4, 5, 6, 7 (uneori vor fi notate cu literele latine K, L. M, N. O, P, Q). Numărul maxim de niveluri de energie al unui element este numeric egal cu numărul perioadei în care acesta este localizat.
Integerul n. care denotă numărul de nivel, se numește numărul cuantumului principal. Caracterizează energia electronilor care ocupă un anumit nivel de energie. Electronii primului nivel de energie cel mai apropiat de nucleu au cea mai mică energie. În comparație cu electronii de la primul nivel, electronii din următoarele nivele se caracterizează printr-o mare rezervă de energie. În consecință, electronii nivelului exterior sunt mult mai puțin asociați cu nucleul.
Numărul maxim de electroni la nivelul energiei este egal cu de două ori pătratul numărului de nivel, adică:
unde N (e -) este numărul de electroni,
n este numărul de nivel (numărarea de la miez) sau numărul principal cuantum.
Deci, la primul nivel de energie, nu pot fi cazați mai mult de doi electroni, pe al doilea - nu mai mult de 8, pe al treilea - nu mai mult de 18, pe al patrulea - nu mai mult de 32.
Nivelul maxim umplut se numește completat, iar carcasa electronică a elementului cu nivelul de energie externă completat este carcasa electronică a gazului nobil 2.
Nivelurile de energie constau în subsoluri. Fiecare sublevel găzduiește de asemenea un număr limitat de electroni. Numărul de subsoluri este determinat de numărul de niveluri de energie. Numarul subvelirilor este egal cu numarul cuantic principal: primul nivel are un subsol, al doilea - doi, al treilea - trei, al patrulea - patru sublevels si asa mai departe. Sublevelle sunt notate cu litere latine 3.
• primul substrat s constă dintr-un s-orbital;
• Cel de al doilea substrat p este format din trei p-orbitale;
• al treilea d-substrat constă din cinci d-orbitali;
• Al patrulea substrat f conține șapte f-orbitale.
Orbital sunt la anumite distanțe de la miez, au o anumită formă și orientare în spațiu. Cea mai simplă formă este sferică (forma unei sfere). Se numește s-orbitală, iar electronii, care se află pe el, sunt s-electroni. P-orbitalul are o formă diferită: este o formă de figură voluminoasă sau o gantere. Astfel de orbitale sunt localizate în atomul de-a lungul axelor reciproc perpendiculare ale coordonatelor spațiale 0 X. 0 Y și 0 Z. și, prin urmare, ele sunt notate cu px. py și p z. Împreună, șase electroni p pot fi acomodați maxim pe trei p-orbitale (două pe fiecare dintre ele). Există, de asemenea, forme mai complexe de orbite:
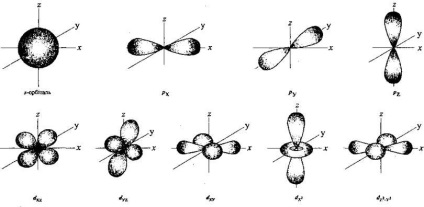
1 Spin (în traducere din engleză - spinning) caracterizează rotația unui electron în jurul axei proprii; unul dintre numerele cuantice (-1/2, +1/2) care descriu proprietățile particulelor elementare. Numerele cuantice în mecanica cuantică sunt valori numerice ale variabilelor cuantice ale unui microobiect care caracterizează starea sa.
2 Ideea stabilității stratului electronic completat oferit un chimist american fizic remarcabil Gilbert Newton Lewis (1875-1946), cu toate că octetul termenul în sine (teoria octetul) el nu a folosit niciodată.
3 denumiri asociate cu literele inițiale ale cuvintelor care semnifica reprezentarea unei posibile forme de nori: (fr. Sferă) nor s-electron are probabil o formă sferică, P - gantelepodіbnu (. Poignees fr), D - diskopodіbnu (fr disque.). Conform noțiunilor moderne, cloud-ul nu are forma de disc, de aceea următoarele orbite sunt indicate de literele alfabetului latin: f. g. h.
2.4.1. Secvența de orbitale de umplere cu electroni
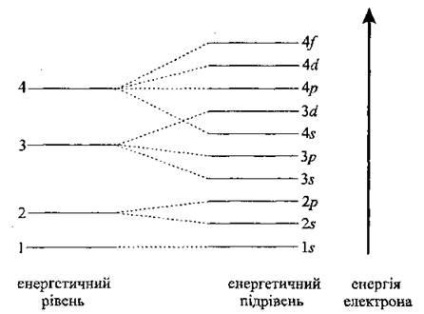
Secvența orbitalilor cu electroni este determinată de mai multe principii. Unul dintre ele este principiul energiei minime: un electron dintr-un atom ocupă o astfel de poziție încât energia sa este minimă (regula Kletschkovskii).
Starea la sol a unui atom este caracterizată de o energie minimă. Și, prin urmare, electronii umple orbitele în scopul creșterii energiei lor. În primul rând, primul nivel de energie este umplut. Următorul (al doilea) este umplut numai după ce primul nivel de energie este complet umplut. Al treilea este umplut după al doilea. Electronii care sunt plasați la nivelul energiei externe sunt numiți externi sau valenți. Ele determină proprietățile chimice ale elementelor.
Într-un nivel, de exemplu, cel de-al doilea, substratul s este umplut mai întâi și apoi substratul p.
Observăm că energia celui de-al 3-lea subsol este mai mare decât energia subsolului 4s și, prin urmare, este umplut mai întâi 4 s. 3 și numai apoi d -poduroven etc. Distribuția nivelelor energetice și subnivele în atom bagatoelektronnomu (în ordinea crescătoare a energiei) .. 1 s 2 s 3 s 2p, 3p 4 4p s d 3 s 4 5 d 5 p 6 s.
Distribuția electronilor în atomul de-a lungul nivelurilor de energie și substraturi este reprezentată sub formă de formule electronice. La compilarea formulelor electronice utilizați următoarele reguli:
1. În timpul umplerii unui subsol, electronii sunt aranjați astfel încât rotația totală să fie maximă (aceasta corespunde stării stabile a atomului) (regula Gund).
2. Rotitele de electroni nepereche pe diferite orbite ar trebui să fie paralele. De exemplu, dacă există 3 electroni pe p-subsol, atunci ele sunt plasate pe trei orbite diferite. py și p z.
Plăcile electronice ale nivelelor și subsolurilor sunt ilustrate prin formule electronice și variantele lor grafice. De exemplu, în prima perioadă sunt plasate numai două elemente - hidrogen (H) și heliu (he). În hidrogen, singurul (neparat) 1 s-electron la primul nivel, care poate fi scris după cum urmează:
Având în vedere că primul nivel poate fi nu mai mult de doi electroni, atomul de heliu a fost deja finalizat - nu 2 1 2 s în atomul de heliu, în primul nivel de energie are doi electroni gemene s cu spin opus.
Elementele celei de-a doua perioade umple al doilea nivel de energie (n = 2). În litiu și Beriliu începe din nou pentru a umple s -poduroven: 3 Li 1 s 2 2 s 1 (a înregistrat, de asemenea, o formulă electronică prescurtata 3 Li [A] s 1. 2 sau 3, Li 2 s 1. că, în viitor, și va continua să facă. ) 2. 4 Noi [He] 2 s 2. Acestea sunt, de asemenea, s-electroni, dar energia lor este mai mare decât în 1 s. Ele formează orbite mari situate mai departe de nucleu.
Următoarele șase elemente, de la Bohr la Neon, umple p-substratul. Formulele electronice pentru aceste elemente sunt următoarele: 5 V [He] 2s 2 2p 1; 6 Sec [El] 2s 2 2 p 2; 7N [He] 2s2 2p3; 8O [He] 2s 2 2 p 4; 9 F [He] 2s 2 2p 5; 10 Ne [2] 2 2p 6.
La cel de-al doilea nivel de energie, așa cum sa indicat deja, nu poate exista mai mult de 8 electroni. Pentru elementele celei de-a treia perioade, începe să se formeze al treilea nivel de energie (n = 3), care poate conține până la 18 electroni; ele sunt numite s-elemente (11 Na [Ne] 3 s 1; 12 Mg [Ne] 3 s 2), și elemente p (13 Al [Ne] 3 s 2 p 3 1; 14 Si [Ne] 3 2 s 3 p 2; 15 P [Ne] 3 s 2 3 p 3; 16 S [Ne] 3 s 2 3 p 4; 17 Cl [Ne] 3 s 2 3 p 5; 18 Ar [Ne] 3 s 2 3 p 6 ).
1 Numărul de electroni nepartiți din atom indică valențele posibile ale elementului. În consecință, hidrogenul are o singură valență - 1.
2 Sub expresia [He], formula electronică a atomului ultimei gaze nobile precedente este prevăzută, în acest caz, cu Heliu.
Articole similare
Trimiteți-le prietenilor: