1. Scrieți ecuațiile de reacție: a) obținerea zincului din oxid de zinc prin reducerea cărbunelui; b) obținerea de cobalt din oxidul de cobalt (II) prin reducere cu hidrogen; c) producerea de titan din magneziu de clorură de titan (IV) prin metoda termică. Reacția în dezasamblare ca redox: indică gradul de oxidare a atomilor și aranjarea coeficienților, determinată prin metoda echilibrului electronic.
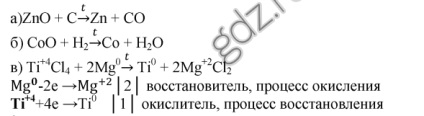
2.Scrieți schemele și ecuațiile de reacții care apar în timpul electrolizei: a) topirea clorurii de potasiu; b) o soluție de bromură de zinc; c) soluția de sulfat feros (II).

3. Care este esența coroziunii metalelor? Ce tipuri de coroziune sunt cunoscute?
Coroziunea este distrugerea spontană a metalelor și a aliajelor ca urmare a interacțiunilor chimice, electrochimice sau fizico-chimice cu mediul.
4. Pe capacul de oțel este pus un nit de cupru. Ce se va prăbuși înainte - un capac sau un nit? De ce?
Capacul de oțel, deoarece include fier, iar fierul este un metal mai activ decât cuprul și va corroza mai degrabă. De asemenea, fierul și cuprul formează un cuplu galvanic, unde fierul este un anod și este distrus mai probabil, în cupru - catodul, rămâne intact.
1. Scrieți ecuațiile reacțiilor: a) obținerea fierului din oxidul de fier (III) printr-o metodă aluminotermică; b) obținerea de cupru din oxidul de cupru (II) prin reducerea cărbunelui; c) obținerea tungstenului din oxidul său superior prin reducerea cu hidrogen. Reacția în dezasamblare ca redox: indică gradul de oxidare a atomilor și aranjarea coeficienților, determinată prin metoda echilibrului electronic.

2.Scrieți schemele și ecuațiile de reacții care apar în timpul electrolizei: a) o soluție de bromură de cupru (II); b) soluția de iodură de sodiu; c) o soluție de nitrat de plumb (II).
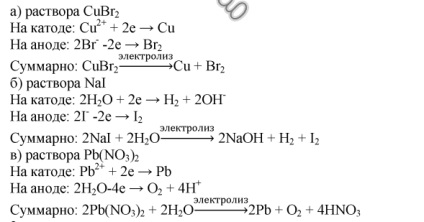
3. Ce factori determină creșterea coroziunii metalelor?
4. De ce se deteriorează rapid rezervorul de fier din tablă de tablă (în tablă) la locul deteriorării stratului protector?
De asemenea, fierul cu staniu formează o celulă galvanică, unde fierul este un anod și este distrus mai repede, iar catodul staniu rămâne neatins.
1. Scrieți ecuațiile de reacție: a) obținerea de cupru din oxidul de cupru (II) prin reducerea cu hidrogen; b) obținerea fierului din oxidul de fier (III) prin reducerea cu monoxid de carbon (II); c) prepararea vanadiului din oxidul de vanadiu (V) prin mijloace termice calcare. Reacția în dezasamblare ca oxidare-reducere: indică gradul de oxidare a atomilor și aranjarea coeficienților, determinată prin metoda echilibrului electronic.
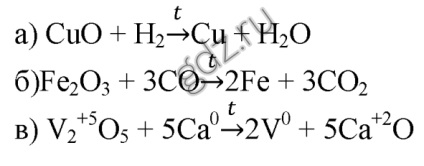
2.Scrieți schemele și ecuațiile de reacții care apar în timpul electrolizei: a) topirea clorurii de calciu; b) o soluție de bromură de potasiu; c) o soluție de sulfat de zinc.

3. Ce factori contribuie la încetinirea coroziunii metalelor?
-Neutralizarea sau deoxigenarea mediilor corozive, precum și utilizarea diferitelor tipuri de inhibitori de coroziune;
-Eliminarea impurităților din metal sau aliaj, accelerarea procesului de coroziune (îndepărtarea fierului din magneziu sau aliajele de aluminiu, sulful din aliajele de fier).
-Eliminarea contactelor metalice nefavorabile sau izolarea acestora, eliminarea decalajelor și golurilor în structură, eliminarea zonelor de stagnare a umezelii.
4. Ce metale în contact reciproc în prezența electrolitului sunt distruse mai rapid: a) cupru și zinc; b) aluminiu și fier? De ce?
Cel mai activ metal dintr-o pereche dată se va deteriora rapid
a) zincul este mai activ decât cuprul;
b) aluminiul este un metal mai activ decât fierul.
1. Scrieți ecuațiile de reacție: a) obținerea molibdenului din oxidul său superior prin reducerea cu hidrogen; b) obținerea cromului din oxidul de crom (III) printr-o metodă aluminotermică; c) producerea de nichel din oxidul de nichel (II) prin reducerea cu carbon. Reacția în dezasamblare ca redox: indică gradul de oxidare a atomilor și aranjarea coeficienților, determinată prin metoda echilibrului electronic.

2.Scrieți schemele și ecuațiile de reacții care apar în timpul electrolizei: a) o soluție de clorură de cupru (II); b) soluția de iodură de sodiu; c) o soluție de nitrat de nichel (II).

3. Listați modalitățile de combatere a coroziunii metalice.

4.De ce zinc este distrus pe rezervorul galvanizat de pe zăbrele, iar fierul nu rugină?
Zincul este mai activ decât fierul. De asemenea, fierul și zincul formează o celulă galvanică, unde zincul este un anod și este distrus mai repede, iar fierul - catodul, rămâne neatins.
Articole similare
Trimiteți-le prietenilor: