Radioactivitatea conversiei spontane a atomilor unui element în atomi ai altor elemente, însoțită de emisia de particule și de radiațiile electromagnetice tari. Istoric istoric. Becquerel. Primăvara anului 1896 fizicianul francez A.Bekkerel a făcut o serie de rapoarte cu privire la descoperirea unui nou tip de radiații ea (mai târziu numit radioactiv) care sunt emise de săruri de uraniu. Ca și razele X descoperite cu câteva luni înainte, avea o capacitate de penetrare, o placă fotografică protejată de hârtie neagră și ionizând aerul înconjurător. Ipoteza care a dus la descoperirea radioactivității, provenită din Becquerel sub influența studiilor Roentgen. Deoarece generarea de raze X a fost observată fosforescență pereți de sticlă tub de raze, Becquerel presupus că orice luminescenta fosforescent este însoțită de emisia de raze X. Pentru a testa această ipoteză, el a pus altă substanță fosforescentă pe placa fotografică învelite în hârtie neagră și a primit un rezultat neașteptat: iluminată a fost singura placa, care este în contact cu un cristal de sare de uraniu. Numeroase experimente de control au arătat că cauza expunerii nu a fost fosforescența, și anume uraniul, în orice compus chimic a fost. Proprietatea radiației radioactive de a provoca ionizarea aerului a făcut posibilă utilizarea unei metode electrice mai convenabile, împreună cu metoda de înregistrare fotografică, care a accelerat foarte mult procesul de cercetare.
Curie. Folosind o metoda electrica, G. Schmidt si M. Curie in 1898 au gasit radioactivitatea elementului de toriu. În anul următor, Debiern a descoperit elementul radioactiv al actiniului. soții P. și M.Kyuri Lansată căutarea sistematică a noilor substanțe radioactive și pentru a studia proprietățile emisiei lor confirmate Becquerel ghici că radioactivitatea compușilor de uraniu este proporțională cu numărul conținut în atomii de uraniu. Printre mineralele examinate, această regulă a fost încălcată numai de minereul de rășină de uraniu (uraninită), care a fost de patru ori mai activ decât cantitatea corespunzătoare de uraniu pur. Curie a concluzionat că uraninitul ar trebui să conțină un element necunoscut extrem de activ. După o separare chimică a uraninitului în componentele constituente, au descoperit radium, asemănător în proprietățile chimice cu bariu, și poloniu, care a fost eliberat împreună cu bismutul.
Rutherford. În studii suplimentare privind radioactivitatea, E. Rutherford a jucat rolul principal. Concentrându-se pe studiul acestui fenomen, el a stabilit natura transformărilor radioactive și a radiațiilor care le însoțesc.
Radiația substanțelor radioactive. Elementele radioactive naturale emit trei tipuri de radiații: alfa, beta și gamma. În 1899, Rutherford a identificat radiația alfa și beta; Un an mai târziu, P. Viiar a descoperit radiațiile gamma.
Alfa radiații. În aer la presiune atmosferică, radiația alfa depășește doar o distanță scurtă, de obicei de la 2,5 la 7,5 cm. În condiții de vid, câmpurile electrice și magnetice deflectă în mod semnificativ de traiectoria inițială. Direcția și magnitudinea abaterilor indică faptul că radiația alfa - un flux de particule încărcate pozitiv pentru care taxa pentru raportul de masă (e / m) exact corespunde de două ori ionizat atom heliu (He ++). Aceste date și rezultatele unui studiu spectroscopic al particulelor alfa colectate au permis Rutherford să concluzioneze că acestea sunt nuclei ai atomului de heliu.
Beta radiații. Această radiație are o putere de penetrare mai mare decât radiația alfa. Ca radiația alfa, se abate în câmpuri magnetice și electrice, dar în direcția opusă și pentru o distanță mai mare. Acest lucru indică faptul că radiația beta este un flux de particule încărcate negativ de masă mică. În ceea ce privește e / m, Rutherford a identificat particulele beta ca electroni obișnuiți.
Gama de radiații. Radiația gamma pătrunde în substanță mult mai adânc decât radiația alfa și beta. Nu deviază într-un câmp magnetic și, prin urmare, nu are o încărcătură electrică. Gama radiațiilor a fost identificată ca o radiație electromagnetică puternică (de exemplu, cu o foarte mare energie). Separația radiației radioactive într-un câmp magnetic în raze alfa, beta și gamma este prezentată schematic în figură.
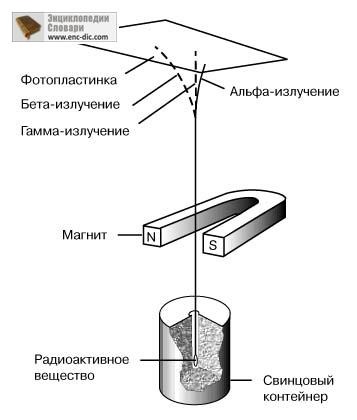
SCHEMA EXPERIMENTALĂ care ilustrează abaterea diferitelor tipuri de radiații radioactive într-un câmp magnetic.
Teoria decăderii radioactive. În procesul de emisie a radiațiilor radioactive, substanța suferă o serie de modificări. Astfel, de exemplu, radiația radială este însoțită de eliberarea radonului gazos ("emanație"). La rândul său, radonul, dezintegrat, lasă depozitele radioactive pe pereții vasului care îl conțin. Emanația colectată în timpul decăderii radiului pierde jumătate din activitatea inițială în aproximativ 4 zile. Acestea și altele să nu cedeze la interpretarea faptelor experimentale poate fi explicată prin teoria dezintegrării radioactive a atomilor, propusă de Rutherford și Soddy în 1903, precum și deplasarea normelor formulate în 1913 A.Rasselom și independent de faianță și Soddy. Esența teoriei lui Rutherford și Soddy este că, ca rezultat al decăderii radioactive, un element chimic este transformat într-altul.
Regula de deplasare. Regula de deplasare indică cu precizie ce transformări suferă elementul chimic, care emit radiații radioactive.
Emisiile de particule alfa și beta. regula de compensare pot fi explicate cu ajutorul modelului nuclear al atomului propus de Rutherford în 1911. Conform acestui model, în centrul atomului este încărcat pozitiv nucleu, care conține cea mai mare parte din masa atomului. În jurul nucleului, electronii se rotesc, încărcarea cărora compensează sarcina pozitivă a nucleului. Fiecare atom este atribuit numărul său atomic Z, care corespunde numărului său de secvență din tabelul periodic și numeric egală cu sarcina nucleară, exprimate în unități de încărcare de electroni. O particulă alfa este Z = 2, iar numărul de masă (greutate atomică rotunjită) A = 4. Dacă un nucleu instabil emite o particulă beta, Z sa este incrementat, iar numărul de masă nu se schimbă. În consecință, atomul radioactiv este transformat în atomul următor în ordine al tabelului periodic. Când emisia de particule alfa și Z Un nou format descreștere de bază la 2 și la 4 unități, respectiv, și atomul copil experimentat de conversie a izotopului corespunzătoare „mutat“ la stânga în Tabelul Periodic al elementului părinte.
Gama de radiații. Electronii orbitali, care au primit un exces de energie, pot trece la niveluri mai mari de energie. Revenind la starea solului (normal), acestea dau surplus de energie sub formă de lumină sau raze X. Nucleul atomilor care au exces de energie poate intra într-o stare excitată. Această excitație este adesea experimentată de nuclei formați în procesul de transformări radioactive. Trecând la starea solului, ele radiază un exces de energie sub formă de quanta gamma. De interes deosebit este varianta de dezintegrare, atunci când nucleul radioactiv are o durată lungă de viață a stării excitate. În acest caz, aceleași nuclee (cu aceleași valori ale lui Z și A) sunt în diferite stări de energie sunt observate dezintegrari radioactive de același tip, dar ele apar la viteze diferite, deoarece unele dintre excitat nuclee degradare, iar altele de la stat la sol. Acest fenomen se numește izomerism nuclear, iar nucleele excitate și normale sunt numite izomeri.
Serii radioactive. deplasare, de obicei, este posibil de a urmări transformarea elementelor radioactive naturale și de a construi trei dintre ele arbore genealogic, din care strămoșii sunt uraniu 238, uraniu-235 și toriu-232. Fiecare familie începe cu un element radioactiv cu durată lungă de viață. Familia de uraniu, de exemplu, capete de uraniu cu numărul de masă 238 și un timp de înjumătățire de 4,5 * 10 9 ani (Tabel. 1, în conformitate cu numele original este desemnat ca uraniul I).
Tabelul 1.
FAMILIA RADIOACTIVĂ A URANIULUI
Timpul de înjumătățire. Cea mai importantă caracteristică a unui atom radioactiv este durata sa de viață. În conformitate cu legea decăderii radioactive, probabilitatea ca un singur atom să se degradeze într-un anumit interval de timp este o valoare constantă. În consecință, numărul de descompuneri care au loc în fiecare secundă este proporțional cu numărul de atomi disponibili, iar legea care descrie procesul de dezintegrare are un caracter exponențial. Dacă o jumătate din numărul inițial de atomi radioactivi se dezintegrează în timpul T, jumătate dintre atomii rămași se descompun în intervalul următor de timp cu aceeași durată. Timpul T se numește timpul de înjumătățire al elementului radioactiv. Pentru diferite elemente, perioada de înjumătățire variază de la zeci de miliarde de ani la milioane de secunde sau mai puțin.
Familia de uraniu. Pe elementele familiei de uraniu, se pot urmări majoritatea proprietăților transformărilor radioactive discutate mai sus. De exemplu, al treilea membru al familiei observă izomerismul nuclear. Uraniul X2, care emite particule beta, este transformat în uraniu II (T = 1,14 min). Aceasta corespunde la descompunerea beta a stării excitate a protactinium-234. Cu toate acestea, în 0,12% din cazuri excitat protactiniu-234 (uraniu X2) emite cuantic gamma și o tranziție la starea de bază (uraniu Z). dezintegrarea beta a uraniului Z, de asemenea, duce la formarea de uraniu II, are loc în 6,7 ore radiul C interesante care se pot dezintegra în două moduri. emitatoare sau alfa sau particule beta. Aceste procese concurează între ele, dar 99,96% din dezintegrarea beta are loc pentru a forma un radiu C „0,04% din C radiu emite o particulă alfa, și este convertită în radiu C“ (RAC „). La rândul său RAC "și RaC" prin emisia de particule alfa și beta, respectiv, transformate în izotopi de radium D. Printre membrii familiei de uraniu se numără și cei ai căror atomi au același număr atomic (aceeași sarcină a nucleilor) și numere de masă diferite. Ele sunt identice în proprietățile chimice, dar diferă în funcție de natura radioactivității. De exemplu, radiul B, radiul D și radiul G, având același număr atomic 82 ca plumbul, sunt similare cu plumbul în comportamentul chimic. Evident, proprietățile chimice nu depind de numărul de masă; ele sunt determinate de structura coajelor de electroni ale atomului (prin urmare, Z). Pe de altă parte, numărul de masă are o importanță decisivă pentru stabilitatea nucleară a proprietăților radioactive ale atomului. Atomii cu același număr atomic și numere diferite de masă se numesc izotopi. Izotopii elementelor radioactive au fost descoperiți de F. Soddy în 1913, dar în curând F. Aston, folosind spectroscopia de masă, a demonstrat că există multe elemente stabile în izotopi.
Alte elemente radioactive naturale. Toate elementele situate în tabelul periodic din spatele bismutului (adică cu Z> 83) sunt radioactive. La fel ca uraniul-238, uraniul-235 cu durată lungă de viață și torio-232 sunt conduse de familii radioactive actinice și torioide. În condiții naturale, se găsesc uraniu, toriu și produsele radioactive ale fiicei lor. Acest lucru se datorează faptului că timpii de înjumătățire ai strămoșilor familiilor sunt comparabili cu vârsta Pământului și nu s-au dezintegrat încă. Elementele chimice cu număr atomic> 92 au fost obținute în laboratoare ca rezultat al reacțiilor nucleare și au fost găsite printre produsele exploziei termonucleare, toate acestea s-au dovedit a fi radioactive. Printre elementele mai ușoare, doar câteva au radioactivitate naturală. Timpii de înjumătățire sunt atât de mari încât încă există pe Pământ în cantități apreciabile. Pulberea radioactivă-40, care emite particule beta, se transformă în calciu stabil-40 (RADIOACTIVITATE T10 9 ani). Cu toate acestea, se poate deteriora prin capturarea unui electron, transformându-se în argon-40. Beta-activ rubidium-87, care se descompune (T RADIOACTIVITY6 * 10 10 ani), trece în stronțiu-87 stabil. Samarul natural 152 este singurul element radioactiv care emite particule alfa care sunt mai ușoare decât bismutul. Timpul de înjumătățire este de 10 12 ani. Elementele cu numerele atomice 43, 61, 85 și 87 nu au nici izotopi stabili, nici precursori de lungă durată, deci nu au fost găsiți pe Pământ. Cel mai îndelungat izotop de technețiu (Z = 43) are un timp de înjumătățire de aproximativ 300.000 de ani, ceea ce este mult mai mic decât vârsta așteptată a universului. Cu toate acestea, o cantitate semnificativă de technețiu a fost găsită în stelele clasei spectrale S. Acest fapt este interpretat ca o dovadă clară că procesele evolutive active au avut loc relativ recent.
Radioactivitate artificială. Bombardarea atomilor de gaz de azot cu particule alfa, în 1919, E. Rutherford și J. Chadwick au efectuat mai întâi o reacție nucleară, provocând conversia azotului în oxigen. Odată cu apariția acceleratoare de particule studii față privind reacțiile nucleare extins în mod semnificativ. În 1934, Frederick și Irene Joliot-Curie au descoperit fenomenul de radioactivitate artificială și un tip de decalaj pozitiv. Ei au descoperit că particulele iradiate alfa de bor, magneziu și aluminiu sunt transformați în izotopi radioactivi ai altor elemente, dezintegrarea este însoțită de emisie de pozitroni (e +). De exemplu, când bombardat cu particule alfa alumină produs fosfor-30 radioactiv, care se degradează (T = 2,5 min) emite e + și transformate în stabil Si-30. Positron deschis în 1932 razele cosmice K.Andersonom generate în radiația secundară este o particulă în greutate și cantitatea de încărcare de electroni identice, dar cu sarcină electrică pozitivă (antiparticula electron). Când poziția este emisă de nucleul unui atom radioactiv, numărul ordinal al atomului scade cu unul, iar numărul de masă rămâne neschimbat.
Capturarea electronică. Capturarea unuia dintre electronii orbitici de către nucleu este echivalentă cu emisia unui positron: numărul de masă al atomului nu se schimbă, iar sarcina nucleului scade cu una. Electronii cochiliilor K și L sunt atât de aproape de nucleu, încât, în unele cazuri, captarea electronică, ca mecanism de dezintegrare radioactivă, începe să concureze cu emisia unui positron. Deoarece captarea unui electron necesită mai puțină energie decât pentru decăderea pozitivă a positronului, uneori, de exemplu, în cazul beriliului-7 (vezi tabelul 2), captarea electronică este posibilă din punct de vedere energetic.
Tabelul 2.
PROPRIETĂȚILE UNOR ATOMURI DE LUMINĂ
Caracteristicile celor mai ușoare atomi stabili și radioactivi sunt arătați în tabelul. 2, unde Z este numărul atomic, iar A este numărul de masă. Masa atomică dată în tabel este exprimată în unități de carbon. În scara energetică, este de 931,162 MeV. Masa atomică caracterizează stabilitatea atomului. Dacă doi atomi au aceleași numere de masă și numere atomice diferite (izobar), izobarul mai greu va fi instabil în raport cu decăderea radioactivă într-o cantitate mai ușoară. Deci, tritiu-3 se transformă în heliu-3, carbon-11 în bor-11.
Aplicarea radioactivității.
Medicina. Radiu și alte radioizotopi naturale sunt utilizate pe scară largă pentru diagnostic si radioterapie a cancerului. Utilizarea radioizotopilor artificiali în acest scop a crescut semnificativ eficacitatea tratamentului. De exemplu, iod radioactiv este introdus în organism ca o soluție de iodură de sodiu, care se acumulează selectiv în glanda tiroidă și, prin urmare, utilizat în practica clinică pentru determinarea tulburărilor funcției tiroidiene și în tratamentul bolii Graves. Folosind etichetat debit sanguin măsurat este determinat și permeabilitatea vaselor sanguine ale membrelor salin de sodiu. Fosforul radioactiv este utilizat pentru a măsura volumul sanguin și a trata eritremia.
Cercetare stiintifica. Etichetele radioactive, în micro-cantitati introduse in sisteme fizice sau chimice, va permit sa monitorizati toate schimbarile care au loc in ele. De exemplu, o plantă care crește în atmosferă de dioxid de carbon radioactiv, chimiștii pot înțelege detaliile subtile ale formării de glucide complexe în plante de dioxid de carbon și apă. Ca rezultat al bombardament continuu al atmosferei terestre prin razele cosmice cu energie ridicată de azot-14 este în neutroni și protoni săi capturând emitatoare transformați în carbon-14 radioactiv. Presupunând că intensitatea bombardamentului și, prin urmare, cantitatea de echilibru de carbon-14 în ultimul mileniu a rămas constantă și dat C-14 înjumătățire perioada de activitate reziduală, poate determina vârsta resturilor animale și vegetale găsite (metoda radiocarbon). Această metodă a reușit să prezinte cu multă siguranță locurile descoperite de omul preistoric, care a existat acum mai bine de 25.000 de ani.
Vezi de asemenea
Structura Atom;
Curie Pierre;
Radiocarbon dating.
REFERINȚE
Doctrina radioactivității. Istorie și modernitate. Radiația nucleară 1973 în știință și tehnologie. M. Furman V. I. Alfa-decay și reacțiile nucleare conexe. M. 1985
Ajutor pentru motoarele de căutare
Articole similare
-
Enciclopedie poliacetilenă - chimică - dicționare explicative și enciclopedii
-
Ecuația de dispersie - enciclopedia matematică - enciclopedie dicționare
Trimiteți-le prietenilor: