Sistemele coloidale în gradul de dispersie ocupă o poziție intermediară între sistemele dispersate cu greutate și soluțiile reale. Prin urmare, ele pot fi obținute în două moduri:
a) prin metode de dispersie - prin strivirea particulelor mai mari la un grad coloidal de dispersie - prin peptizare mecanică, electrică, cu ultrasunete (conversia precipitațiilor într-o soluție coloidală sub influența substanțelor chimice - peptizatoare);
b) prin metode de condensare - prin coagularea particulelor în agregate de grad de dispersie coloidală (obținând substanțe insolubile ca urmare a reacțiilor de diferite tipuri);
c) ultrafiltrarea prin membrane semipermeabile.
Structura particulelor coloidale
Formarea unei substanțe insolubile ca urmare a unei reacții chimice este doar una dintre condițiile pentru obținerea unei soluții coloidale. O altă condiție la fel de importantă este inegalitatea substanțelor inițiale luate în reacție. O consecință a acestei inegalități este limitarea creșterii dimensiunii particulelor coloizilor soluțiilor, ceea ce ar conduce la formarea unui sistem dispersat grosier.
Mecanismul de formare a unei particule coloidale este luat în considerare pe exemplul formării solului de iodură de argint, care se obține prin interacțiunea soluțiilor diluate de azotat de argint și iodură de potasiu.
Moleculele neutre de iodură de argint neutră formează nucleul unei particule coloidale.
La început, aceste molecule se unesc în dezordine, formând o structură amorfă, care se transformă treptat într-o structură de cristal extrem de ordonată a nucleului. În exemplul pe care îl considerăm, miezul este un cristal de iodură de argint cristal, constând dintr-un număr mare (m) de molecule Agl:
m [Agl] este nucleul unei particule coloidale
Pe suprafața nucleului se produce un proces de adsorbție. Conform regulii lui Peskov-Fayans, pe suprafața nucleelor particulelor coloidale, ionii care intră în miezul particulei sunt adsorbiți; ionii de argint adsorbiti (Ag +) sau ionii de iod (I -). Dintre aceste două tipuri de ioni, cele care sunt în exces sunt adsorbite.
Deci, dacă obțineți o soluție coloidală în exces de iodură de potasiu, atunci iodurile de iod se vor adsorbi pe particule (nuclee), care completează rețeaua cristalină a nucleului, intră în mod natural și ferm în structura sa. În acest caz, se formează un strat de adsorbție, care dă nucleului o încărcare negativă:
Ionii adsorbiți pe suprafața nucleului, dându-i o încărcătură corespunzătoare, se numesc ioni care formează potențial.
În acest caz, în soluție există și ioni încărcați opus, se numesc contraioni. În cazul nostru, aceștia sunt ionii de potasiu (K +), care sunt atrasi electrostatic de un nucleu încărcat (încărcarea poate ajunge la I c). O parte din contra ionii K + este puternic legată de forțele electrice și de adsorbție și intră în stratul de adsorbție. Un nucleu cu un strat dublu de adsorbție de ioni format pe el se numește granule.
Partea rămasă a contraionilor (numită prin numărul lor "x K +") formează un strat difuz de ioni.
Un nucleu cu un strat de adsorbție și difuz este numit micelă:
Atunci când un curent electric direct este trecut prin soluția coloidală, granulele și contraionul se deplasează la electrozii încărcați opuși.
Prezența aceleiași încărcări pe suprafața particulelor de sol este un factor important în stabilitatea sa. Încărcarea împiedică coalescența și coagularea particulelor. Într-un sistem dispersat stabil, particulele sunt păstrate într-o stare suspendată, adică nu există nici o precipitare a materiei coloidale. Această proprietate a soluțiilor se numește stabilitate cinetică.
Structura micelilor solului de iodură de argint obținută în exces de AgN03. este prezentat în Fig. 1a, în exces KCI-1b.
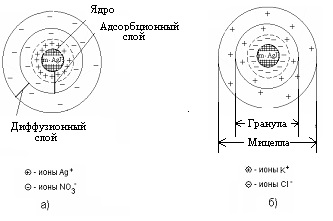
Figura 1.5. Structura micelurilor de sol de iodură de argint obținută în exces:
a) azotatul de argint; b) clorură de potasiu.
Trimiteți-le prietenilor: