Procesul de dizolvare nu poate fi considerat ca o distribuție mecanică simplă a unei substanțe în alta. Când sunt dizolvate, au loc interacțiuni fizico-chimice ale substanței dizolvate cu moleculele de solvent.
Procesul de dizolvare este adesea însoțit de absorbția sau eliberarea căldurii. Aceasta indică faptul că particulele substanței dizolvate formează compuși chimici cu moleculele de solvent. Acești compuși se numesc solvați. și procesul de formare a acestora prin solvație. În cazul în care solventul este H2O prin hidratare și hidratare.
După cum sa menționat deja, procesul de dizolvare este un proces fizico-chimic complex în care se manifestă interacțiuni între particule de natură chimică diferită.
Procesul de dizolvare este puternic influențat de polaritatea moleculelor solventului și a substanței dizolvate.
Polaritatea solventului este caracterizată de constanta sa dielectrică e. cu cât solventul este mai polar, cu atât mai mare e.
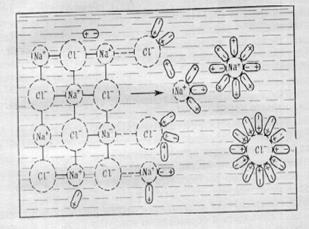
Procesul de dizolvare este după cum urmează (figura 1):
Procesul de dizolvare este următorul (Fig.1): moleculele polare ale solventului cu polii negativi ajung la atomii pozitivi ai rețelei de cristal, iar cei pozitivi la cei negativi. Și astfel, formarea unei legături de solvat este mai puternică decât legătura ionică din cristal. Ca rezultat al mișcării termice, se descompune complet și există o solvație completă a acelor particule care se află în adâncul soluției.
Trebuie menționat faptul că procesul de hidratare este însoțit de eliberarea căldurii, numită solvație termică (hidratare).
Articole similare
Trimiteți-le prietenilor: