Toate substanțele în stare solidă au o structură cristalină sau amorfă.
Într-o substanță amorfă (sticlă, colofoniu) atomii sunt localizați haotic, fără nici un sistem.
Într-o substanță cristalină, atomii sunt aranjați într-un model geometric corect și la o anumită distanță unul față de celălalt.
Toate metalele aliajului au o structură cristalină.
Granulele cristaline au o formă nedefinită și nu arată ca cristalele tipice - polyhedra, de aceea se numesc cristalite, boabe sau granule. Cu toate acestea, structura internă a cristalitelor nu diferă în nici un fel de structura internă a cristalelor.
Tipuri de laturi cristaline. Când se solidifică, atomii de metal formează sisteme geometrice obișnuite, numite laturi de cristal,
Ordinea dispunerii atomilor în zăbrele poate fi diferită, metale skie formează un grilaj, protozoarele (elementare; celule care sunt centrate cubi [a- și b-fier, crom, molibden, wolfram, vanadiu, mangan] -centered fețele cubice [y-fier, aluminiu, cupru, nichel, plumb sau hexagonală, în formă de prismă hexagonală (magneziu, zinc, a-titan, a-cobalt).
Celula elementară este repetată în trei dimensiuni, formând o latură cristalină, astfel încât poziția atomilor din celula unică determină structura întregului cristal.
Celula elementară a cubului centrat (Figura 1) constă din nouă atomi, dintre care opt sunt localizați de-a lungul vârfurilor cubului, iar al nouălea în centrul său.
Pentru a caracteriza zăcământul cristal (structura atomică a cristalului), se utilizează o latură spațială, care este o schemă geometrică a rețelei cristaline și constă din puncte (noduri) aflate în mod natural în spațiu.
În Fig. 2 prezintă partea laturii spațiale a cubului centrat. Aici sunt luate opt celule adiacente elementare; Nodurile situate de-a lungul vârfurilor și în centrul fiecărei celule sunt marcate cu cercuri.
Celula elementară a cubului cu fețe centrate (Figura 3) constă din 14 atomi, dintre care 8 atomi sunt localizați de-a lungul vârfurilor cubului și 6 atomi sunt pe laturi.
În Fig. 4 prezintă o parte a rețelei spațiale a unui cub cu fețe centrale (cub centrat pe față). Există opt celule elementare pe diagramă: nodurile sunt situate de-a lungul vârfurilor și de-a lungul centrelor fețelor fiecărei celule.
Celula hexagonală este formată din 17 atomi, din care 12 atomi sunt situați de-a lungul vârfurilor prismei hexagonale, 2 atomi - în centrul bazei și 3 atomi - în interiorul prismei.
Pentru a măsura distanța dintre atomii vecini de laturi cristaline, utilizați o unitate specială numită Angstrom (A); A = 10
Parametrul lattice (partea laterală a unui cub sau hexaedron) din cupru este de 3,6 A, iar pentru aluminiu 4,05 A, pentru zinc 2,67 A și așa mai departe.
Fiecare atom constă dintr-un nucleu încărcat pozitiv și mai multe straturi (cochilii) de electroni încărcați negativ care se deplasează în jurul nucleului. Electronii carcaselor exterioare ale atomilor de metal, numiți învelișuri de valență, se desprind ușor, se mișcă rapid între nuclee și se numesc liberi.
Datorită prezenței electronilor liberi, atomii de metal sunt ioni încărcați pozitiv.
Astfel, la punctele de zăbrere indicate de cercurile din Fig. 2 și 4, există ioni încărcați pozitiv. Ionii, totuși, nu sunt în stare de repaus, ci continuă să oscileze în jurul poziției de echilibru. Cu temperatură în creștere, amplitudinea oscilațiilor crește, ceea ce provoacă expansiunea cristalelor, iar la temperatura de topire, vibrațiile particulelor cresc atât de mult încât conduc la distrugerea rețelei de cristal.
Fig. 1. Celula elementară a unui cub centrat
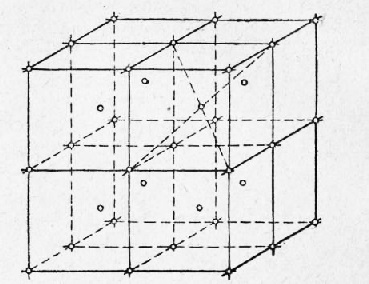
Fig. 2. Partea latticei spațiale a cubului centrat
Fig. 3. Celula elementară a unui cub cu fețe centrate
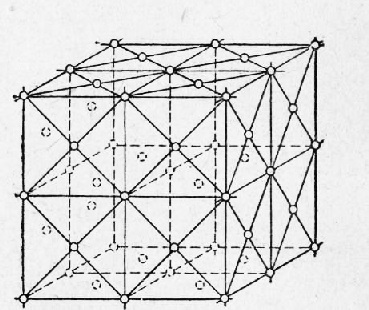
Fig. 4. Parte a rețelei spațiale a unui cub cu fețe centrale
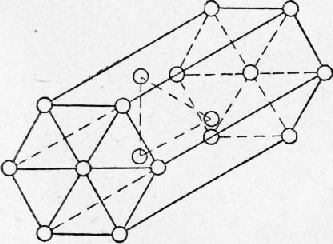
Fig. 5. Celula hexagonală
În toate cristalele, există abateri mici față de nodurile ideale ale rețelelor neocupate și diferitele deplasări atomice. În Fig. 34 prezintă schema de structură a laturilor ideale și reale de cristal.
Anizotropia și scindarea cristalelor. În cristalele individuale, proprietățile sunt diferite în direcții diferite. Dacă luăm un cristal mare, tăiem mai multe probe identice în dimensiune, dar diferite și încercăm, uneori este posibil să se obțină o diferență foarte importantă în proprietățile dintre eșantioanele individuale. De exemplu, la testarea probelor tăiate dintr-un cristal de cupru, valoarea de alungire a variat de la 10 la 55%, iar valoarea rezistenței la tracțiune a fost de 14 până la 35 kg / m2 pentru diferite probe. Această proprietate a cristalelor se numește anizotropie. Anizotropia cristalelor se explică prin aranjarea specifică a atomilor din spațiu.
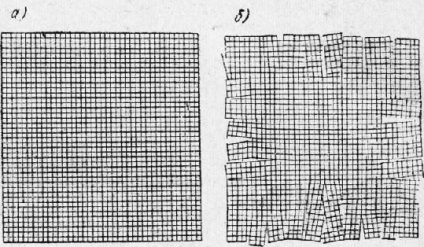
Fig. 6. Schema structurii cristalelor ideale (a) și reale (b)
Consecința anizotropiei cristalelor este scindarea, care se revelează la distrugere. În locurile în care cristalele se sparg, se pot observa planuri corecte, ceea ce indică faptul că deplasarea particulelor sub influența forțelor exterioare nu are loc în mod aleatoriu, ci în rânduri regulate, într-o anumită direcție, în funcție de dispunerea particulelor din cristal. Aceste avioane se numesc avioane de scindare.
Corpurile amorfe sunt izotropice, adică toate proprietățile lor sunt identice în toate direcțiile. Fractura unui corp amorf are întotdeauna o suprafață coajă neregulată, curbată, așa-numită.
Metalele, solidificate în condiții obișnuite, nu constau dintr-un singur cristal, ci dintr-un număr mare de cristale separate, orientate diferit față de celălalt, prin urmare proprietățile metalului turnat vor fi aproximativ identice în toate direcțiile; acest fenomen se numește cvasisotropie (izotropie aparentă).
Allotropia metalelor. Allotropia (sau polimorfismul) metalelor se numește proprietatea lor de a avea o structură diferită la temperaturi diferite. Allotropia este detectată de toate elementele care au o valență care variază odată cu schimbarea temperaturii: fier, mangan, nichel, staniu etc. Fiecare transformare alotropică are loc la o anumită temperatură. De exemplu, una dintre transformările fierului are loc la o temperatură de 910 °, sub care atomii formează o latură a unui cub centrat și deasupra ei o latură a unui cub centrat pe față.
Această structură sau această structură se numește forma alotropă sau modificarea. Diferite modificări pentru a desemna literele grecești a, (3, y și r. H. în formă de indici, și în care atributul literă modificatoare existent la tempera-runde mai întâi sub transformarea alotropică. Transformare alotropică însoțită de eliberarea sau absorbția căldurii.
Cristalizarea metalelor. Cristalizarea metalelor este formarea cristalelor în metale (și aliaje) atunci când trec de la o stare lichidă la o stare solidă (cristalizarea primară). Recristalizarea dintr-o modificare în alta în timpul răcirii metalului solidificat se numește cristalizare secundară. Procesul de cristalizare a metalului este cel mai ușor de urmărit cu ajutorul unui contor de timp și a unui pirometru termoelectric, care reprezintă un milivoltmetru 2 conectat la un termocuplu. Termocuplu (două fire diferite, capete lipite) sunt scufundate în metal topit. Termocurentul rezultat este proporțional cu temperatura metalului, iar acul milivoltmetru deviază, indicând această temperatură pe o scară specială.
Citirile pirometrului sunt înregistrate în timp și din datele obținute, curbele de răcire sunt reprezentate grafic în coordonatele temperatură-timp.
Temperatura corespunzătoare oricărei transformări în metal se numește punctul critic.
În Fig. 8a prezintă curba obținută atunci când metalul este încălzit. Aici, secțiunea orizontală (locul ab) indică locul punctului de topire critic tnjl. Punctul a corespunde începutului topirii, punctul b până la sfârșitul topirii.
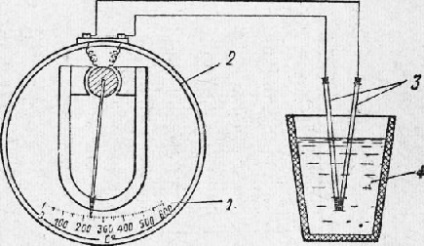
Fig. 7. Diagrama schimbării temperaturii metalului cu ajutorul unui pirometru termoelectric
Secțiunea ab caracterizează temperatura neschimbată în timp cu încălzirea continuă. Aceasta arată că energia termică se consumă pe transformarea internă a metalului, în acest caz transformarea metalului solid în lichid (căldura latentă de fuziune).
Când se răcește, trecerea de la o stare lichidă la o stare solidă este însoțită de formarea unei rețele de cristal, adică cristalizarea.
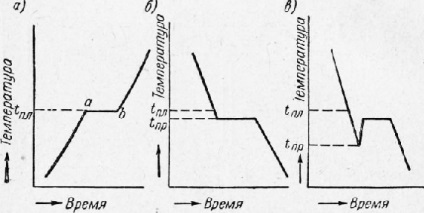
Fig. 8. Curbele de încălzire (a) și răcire (b - fără buclă, c - buclă) din metal
Unele subrăcire metale (tnx - TNP) este foarte mare (pentru antimoniu, de exemplu, 40 °) și la o temperatură de subrăcire rapid odată ce TNP cristalizarea începe, determinând temperatura crește brusc aproape la tnjl. În acest caz, pe grafic se formează o buclă de histerezie termică.
Odată cu solidificarea și transformarea alotropică în metal, se formează mai întâi centre de cristalizare în jurul cărora atomii sunt grupați, formând respectiva rețea cristalină.
Astfel, procesul de cristalizare constă în două etape: formarea de centre de cristalizare și creșterea cristalelor.
În fiecare dintre cristalele emergente, planurile cristalografice sunt orientate aleatoriu, în plus, în timpul cristalizării primare, cristalele se pot roti, deoarece sunt înconjurate de un lichid. Cristalele adiacente cresc unul față de celălalt și punctele de coliziune determină granițele cristalitelor (granule).
În substanțele amorfe, curbele de răcire sunt netede, fără tampoane și bănci; Este clar că alotropia acestor substanțe nu poate fi.
Cristalizarea ferului. Luați în considerare, ca exemplu, procesul de cristalizare și punctele critice ale fierului, cel mai important metal tehnic.
În Fig. 9 prezintă curbele de răcire și de încălzire a fierului pur. Fierul se topește la o temperatură de 1539 °. Prezența punctelor critice la temperaturi mai scăzute indică faptul că fierul are mai multe modificări alotropice în stare solidă.
Punctele critice ale transformării fierului sunt notate cu litera A, care atribuie litera c încălzirii, iar litera r se răcește; indicii 2, 3 și 4 servesc la diferențierea transformărilor alotropice unul de altul (indexul 1 este rezervat pentru indicarea transformărilor în diagrama de stare Fe-Fe3C.
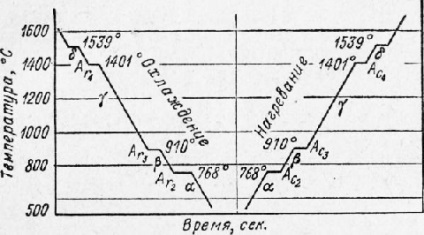
Fig. 9. Curbele de răcire și încălzire a fierului
La temperaturi sub 768 °, fierul are proprietăți magnetice și are o latură de cristal a unui cub centrat. Această modificare se numește fier: atunci când este încălzită, trece la modificarea nemagnetică a fierului P în punctul Asg.
Structura cristalului nu se modifică (conform conceptelor moderne, transformarea magnetică este asociată cu schimbări în cochiliile electronice ale atomilor), prin urmare p-fierul este de asemenea numit a-fier nemagnetic.
La punctul Ac3 la o temperatură de 910 °, fierul P (non-magnetic a-fier) trece în y-fier, care are o latură cristalină a unui cub cu fața în cub.
La punctul At4 la 1401 °, y-fierul trece în 6-fier, latura cristalină fiind reconvertată de la cubul centrat pe față în cubul centrat.
La răcire, aceleași tranziții vor avea loc numai în ordine inversă.
Dintre transformările enumerate, cea mai mare semnificație practică este transformarea la punctul A3, atât cu încălzire cât și cu răcire.
y-fierul este capabil să dizolve până la 2% carbon la o temperatură de 1130 °; a-fier - până la 0,025% la 723 ° și numai 0,006% la 0 °. Proprietatea y-fierului pentru a dizolva o cantitate semnificativă de carbon este utilizată pentru a produce o serie de operațiuni de tratare termică și chimică-termică.
Transformarea la punctul A3 este asociată cu o schimbare a volumului, deoarece densitatea rețelei cristaline a y-fierului este mai mare decât densitatea rețelei a-fier.
Citește mai mult:
Articole similare:
Articole similare
Trimiteți-le prietenilor: