Obținerea amoniacului. Vom efectua toate acțiunile descrise în manual.
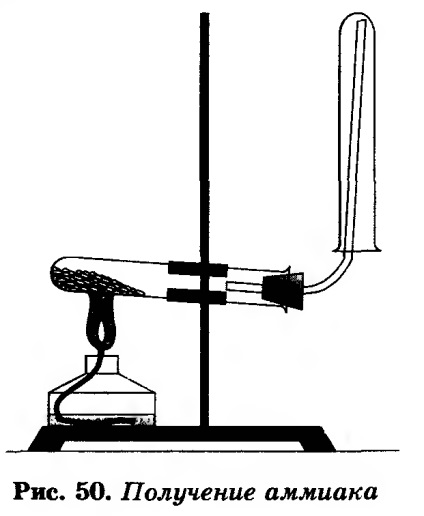
Asamblați instrumentul așa cum se arată în figura 50.
Pe o foaie de hârtie sau într-o cană mică de porțelan (puteți mortar), se toarnă clorură de amoniu și hidroxid de calciu cu un volum de o lingură (o linguriță pentru substanțe de ardere).
Se amestecă amestecul cu o tijă de sticlă și se toarnă într-un tub de testare uscat. Închideți-l cu un dop cu un tub de evacuare a gazului și fixați-l în picioarele trepiedului.
Când întăriți dispozitivul la baza trepiedului, acordați atenție pantei tubului în raport cu deschiderea acestuia. Pe conducta de gaz, puneți pe un tub uscat pentru a colecta amoniac.
Un tub cu un amestec de clorură de amoniu și hidroxid de calciu calcă mai întâi toate (2-3 mișcări
flacără) și apoi se încălzește în locul unde este amestecul. Pentru a detecta amoniacul, introduceți o hârtie de fenolftaleină umedă în orificiu cu inversul inversat al tubului. După detectarea amoniacului, aduceți o tijă de sticlă umezită cu acid clorhidric concentrat la deschiderea tubului. Ce cauți? Scrieți ecuațiile de reacție.
Opriți încălzirea amestecului. Tubul în care amoniacul colectat, îndepărtați cu grijă tubul de gaz de descărcare, ținându-l cu susul în jos (capătul tubului de vapori imediat după îndepărtarea aproape de o bucată de vată umedă l tampon cu amoniac).
Închideți imediat deschiderea tubului de test îndepărtat cu degetul mare și coborâți-l într-un recipient de apă. Un deget este luat numai sub apă. Ce cauți? De ce a crescut apa într-o eprubetă? Închideți din nou gaura tubului de testare sub apă cu degetul și scoateți-l din vas.
1. De ce, în acest caz, un tub cu un amestec de substanțe trebuie să fie întărit în picioarele trepiedului astfel încât fundul lui să fie ușor deasupra capătului deschis? Înregistrarea ecuației de reacție dintre clorura de amoniu și hidroxidul de calciu vă va ajuta să răspundeți la întrebare.
2. De ce este colectat amoniacul într-un tub întoars cu capul în jos? Ce alte gaze pot fi colectate în acest fel?
3. Ce se poate observa dacă, în locul acidului clorhidric, o tijă umezită cu acid azotic concentrat este adusă la deschiderea unui tub cu amoniac? Scrieți ecuația de reacție.
4. Cum pot dovedi că ionii de hidroxid sunt conținute într-o soluție apoasă de amoniac?
Studiul proprietăților unei soluții apoase de amoniac
1. Se toarnă 2-3 ml de soluție apoasă de amoniac în tub și se adaugă 2-3 picături de soluție de fenolftaleină. Care este culoarea soluției? Încălziți această soluție la fierbere. Cum se va schimba culoarea soluției? Ce a cauzat această schimbare?
2. Se toarnă 2-3 ml de amoniac apos în tub. Se adaugă 2-3 picături de soluție de fenolftaleină și se adaugă, în picături, o soluție de acid clorhidric până la dispariția culorii de zmeură. De ce a dispărut tabloul? Scrieți ecuațiile reacției ionice (întregi și scurte).
3. Se toarnă 2-3 ml de soluție apoasă de clorură de aluminiu în tub și se adaugă cât mai mult din aceeași soluție apoasă de amoniac. Ce cauți? Scrieți ecuațiile reacției ionice (întregi și scurte).


Studiul proprietăților unei soluții apoase de amoniac.

Articole similare
Trimiteți-le prietenilor: