Compoziția de echilibru a gazului de apă la P = 0,1 MPa, compusă ținând cont de formarea metanului, arată că, la temperaturi de până la 900 ° C, trebuie luată în considerare reacția de formare a metanului. Cu toate acestea, nu trebuie să se presupună în prealabil că formarea metanului are timp să curgă complet la starea de echilibru.
Prin valoare calorică se înțelege căldura de ardere completă a unei unități de masă a materiei. Aceasta ia în considerare pierderile de căldură asociate cu disocierea produselor de ardere și incompletența reacțiilor chimice de combustie. Valoarea calorică reprezintă căldura maximă de ardere posibilă pe unitatea de masă a materiei.
Determinați valoarea calorică a elementelor, a compușilor acestora și a amestecurilor de combustibili. Pentru elemente, este numeric egal cu căldura de formare a produsului de ardere. Valoarea calorică a amestecurilor este o valoare aditivă și poate fi găsită dacă valoarea calorică a componentelor amestecului este cunoscută.
Arderea are loc nu numai datorită formării oxizilor, astfel încât, în cel mai larg sens se poate vorbi de elemente calorice și compușii lor sunt nu numai oxigen, ci și prin reacția cu fluor, clor, azot, bor, carbon, siliciu, sulf și fosfor.
Valoarea calorică este o caracteristică importantă. Ea face posibilă evaluarea și compararea cu ceilalți a eliberării maxime posibile de căldură a uneia sau a altei reacții de reducere a oxidării și pentru a determina gradul de completare al proceselor de ardere efective în raport cu aceasta. Cunoașterea valorii calorice este necesară pentru alegerea componentelor combustibililor și a amestecurilor în diverse scopuri și pentru evaluarea caracterului complet al arderii.
1.17. Valoarea calorică a materialelor combustibile
Distingeți între valorile calorifice superioare H și HH inferioare. Valoarea calorifică mai mare, spre deosebire de cea inferioară, include căldura transformărilor de fază (condensare, solidificare) a produselor de ardere la răcire la temperatura camerei. Astfel, valoarea calorifică mai mare este căldura de combustie completă a substanței, atunci când starea fizică a produselor de ardere este considerată la temperatura camerei și cea mai mică - la temperatura de combustie. Valoarea calorică mai mare este determinată de arderea substanței într-o bomba calorimetrică sau prin calcul. Acesta include, în special, căldura eliberată în timpul condensării vaporilor de apă, care la 298 K este de 44 kJ / mol. Valoarea calorifică inferioară este calculată fără a lua în considerare căldura de condensare a vaporilor de apă, de exemplu prin formula
H n = H e - 50,45 (% H),
starea fizică a produselor de combustie (solide, lichide sau gazoase), caz în care indicii "mai mare" și "inferior" sunt, de obicei, omisi.
Să luăm în considerare valoarea calorică a hidrocarburilor și a elementelor în oxigen, pe unitatea de masă a combustibilului original. Valoarea calorică netă este diferită de parafine superioare de la o medie de 3220-3350 kJ / kg, de la olefine și naftene - pe 3140-3220kDzh / kg, din benzen - până la 1590 kJ / kg. În determinarea experimentală a valorii calorice, trebuie avut în vedere că într-o bomba calorimetrică substanța arde la un volum constant și în condiții reale - adesea la o presiune constantă. Corecția pentru diferența dintre condițiile de ardere a combustibilului solid de la 2,1 până la 12,6, pentru păcură - circa 33,5, benzină - 46,1 kJ / kg, iar gazul ajunge la 210 kJ / m 3. În practică, această corecție este introdusă numai atunci când se determină valoarea calorică a gazului.
În parafine, valoarea calorică scade
cu o creștere a punctului de fierbere și o creștere a raportului C / H. În hidrocarburile aliciclice monociclice, această schimbare este mult mai mică. În seria de benzen, valoarea calorică crește odată cu trecerea la omologi mai mari datorită lanțului lateral. Dinuclear aromatic-
Capitolul 1. Procesele fizico-chimice în combustie
hidrocarburile au o valoare calorică mai mică decât seria de benzen.
Numai câteva elemente și compușii lor au o valoare calorică care depășește valoarea calorică a combustibililor cu hidrocarburi. Printre aceste elemente se numără hidrogenul, borul, beriliul, litiul, compușii lor și câțiva compuși organici organici de bor și beriliu. Valoarea calorică a elementelor, cum ar fi sulf, sodiu, niobiu, zirconiu, calciu, vanadiu, titan, fosfor, magneziu, siliciu și aluminiu, este în intervalul 9210-32 240 kJ / kg. Pentru elementele rămase ale sistemului periodic, valoarea calorică nu depășește 8,374 kJ / kg. Datele privind valoarea calorifică mai mare a unei clase de combustibili diferite sunt prezentate în tabelul. 1.18.
Valoarea calorică mai mare a diferitelor combustibili din oxigen (pe unitatea de masă a combustibilului) [36] 1
Pentru hidrocarburile lichide, metanol și etanol, valoarea calorică este dată pentru starea inițială lichidă.
Valoarea calorică a unor combustibili a fost calculată pentru un calculator. Este de 24,08 pentru magneziu și 31,08 kJ / kg pentru aluminiu (starea de oxizi este solidă) și practic coincide cu datele din tabel. 1.18. Valoare calorifică mai mare
parafină capacitate C 26 H 54 C 10 H naftalină antracen 8. C 14 H 10 și C 6 hexamine H 12 N 4 sunt, respectiv, 47,00, 40,20, 39,80 și 29,80, iar inferior - 43.70 , 39,00, 38,40
De exemplu, cu referire la combustibilii cu rachete, vom da valorile calorifice ale diferitelor elemente în oxigen și fluor, pe unitatea de masă a produselor de ardere. Valorile calorifice sunt calculate pentru starea produselor de combustie la o temperatură de 2700 K și sunt prezentate în Fig. 1,25 și în tabelul. 1.19.
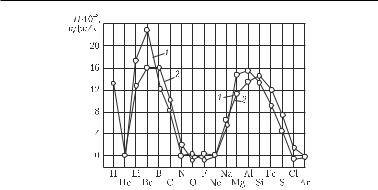
Capitolul 1. Procesele fizico-chimice în combustie
Fig. 1.25. Căldura de ardere a elementelor în oxigen (1) și fluor
(2), calculat pe kilogram de produse de ardere
După cum rezultă din datele date, pentru obținerea căldurii maxime de ardere, cele mai preferate sunt substanțele care conțin hidrogen, litiu și beriliu și, în al doilea rând, bor, magneziu, aluminiu și siliciu. Avantajul hidrogenului datorat greutății moleculare mici a produselor de ardere este evident. Trebuie remarcat avantajul beriliului datorită valorii calorifice ridicate.
Este posibil să se formeze produse de combustie mixte, în special oxifluoruri de elemente gazoase. Deoarece elementele trivalente sunt cele mai stabile oxifluoruri, cele mai multe oxifluoruri nu sunt eficiente ca produse de combustie pentru combustibilii racheta din cauza greutății lor moleculare înalte. Căldura de ardere cu formarea COF2 (g) are o valoare intermediară între valorile calorifice ale CO 2 (g) și CF 4 (g). Căldura de ardere cu formarea SO2F2 (g) este mai mare decât în cazul formării SO2 (g) sau SF6 (g). Cu toate acestea, majoritatea combustibililor din rachete conțin elemente cu capacitate mare de reducere, care împiedică formarea unor astfel de substanțe.
Formarea oxigenului de aluminiu AlOF (g) produce mai puțină căldură decât atunci când se formează un oxid sau fluorură, deci nu este de interes. Oxyfluorura de bor BOF (g) și trimerul său (BOF) 3 (g) sunt componente importante ale produselor de combustie ale combustibililor rachetă. Căldura de ardere cu formarea BOF (g) are o valoare intermediară între încălzirile de combustie pentru a forma un oxid și o fluorură, dar oxifluorura este termic mai stabilă decât fiecare dintre acești compuși.
1.17. Valoarea calorică a materialelor combustibile
Încălzirea arderii elementelor (în MJ / kg) pe unitatea de masă a produselor de combustie (T = 2700 K)
Când se formează nitrurile de beriliu și bor, se eliberează o cantitate suficientă de căldură, ceea ce face posibilă clasificarea acestora ca fiind componente importante ale produselor de combustie ale combustibililor de rachetă.
În tabel. 1.20 prezintă valoarea calorică superioară a elementelor atunci când interacționează cu diferiți reactivi, referindu-se la o masă unitară de produse de combustie. Valoarea calorică a elementelor în interacțiunea cu clor, azot (cu excepția formării Be 3 N 2 și BN), bor, carbon, siliciu, sulf și fosfor semnificativ mai puțin elemente calorice care interacționează cu oxigenul și fluor. O mare varietate de cerințe privind procesele de combustie și reactivi (temperatura, compoziția, starea produselor de ardere etc.) face ca utilizarea datelor din tabel să fie utilă. 1.20 în dezvoltarea practică a amestecurilor de combustibil cu un anumit scop.
Pentru a continua descărcarea, trebuie să colectați imaginea:
Articole similare
Trimiteți-le prietenilor: