Sarcina 1.
Aliajul de cupru și argint a fost tratat cu un exces de acid azotic concentrat. Masa de nitrați obținută a fost de 49 g. În plus, s-a adăugat acidul bromhidric în exces la soluția rezultată. Ca rezultat, 50 g de precipitat au căzut. Determinați fracția de masă a fiecărui metal din aliajul original.
având în vedere:
masa nitraților metalici: mol = 49 g;
greutatea sedimentului: sedimentare = 50 g.
Caută:
fracția de masă a cuprului din aliajul inițial: (Cu) =?
fracțiune de masă de argint în aliajul original: (Ag) =?
soluţie:
În acest caz, aliajul a două metale poate fi considerat ca un amestec de substanțe individuale. În primul rând, să analizăm transformările chimice descrise în condiție.
1. Ambele metale interacționează cu acidul azotic concentrat:
2. Numai azotatul de argint reacționează pentru a forma un precipitat cu acid bromhidric. HBg în acest caz este un reactiv selectiv al iaAgNO3:
Astfel, în greutate a precipitatului AgBr, este posibil să se determine masa AgNO3 într-un amestec de nitrați și, folosind masa totală de nitrați, să se calculeze masa azotatului de cupru. Mai mult, în funcție de reacțiile cu HNO3, este posibil să se determine masa fiecăruia dintre metalele din aliajul inițial și să se găsească fracțiile de masă.
Algoritmul de decizie poate fi reprezentat după cum urmează:
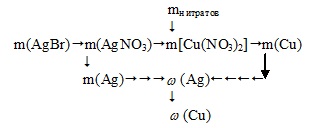
3. Prin ecuația formării unui precipitat, determinăm masa azotatului de argint.
Să compunem proporția:
x g AgN03 dă 50 g de AgBr (conform condiției)
169,9 g de AgN03 dau 187,8 g AgBr (prin ecuația)
4. Cu ajutorul masei totale de nitrați, se determină masa azotatului de cupru (II).
5. Se determină masa cuprului în azotatul de cupru. Acest lucru se poate face prin ecuația de reacție a reacției cuprului cu acidul azotic, dar este posibilă chiar prin formula nitratului.
În 187,5 g de Cu (NO3) 2 conține 63,5 g de Cu (cu valoarea lui M)
În 3,8 g de Cu (NO3) 2 conține xuCu (prin condiția problemei)
(masa cuprului din aliaj original).
6. De asemenea, determinăm masa argintului în 45,2 g azotat de argint.
M (AgN03) = m (Ag) + M (N) + M (O). 3 = 107,9 + 14 + 48 = 169,9 g / mol.
În 169,9 g de AgN03 conțin 107,9 g de Ag (prin valoarea lui M)
În 45,2 g AgNO3 conține x g Ag (prin condiția problemei)
(masa argintului din aliajul original).
7. Gasim fractia de masa de argint in aliaj.
8. Gasiti fractia de masa de cupru din aliaj.
(Cu) = 100% - (Ag) = 100% - 95,7 = 4,3%
Răspuns: (Ag) = 95,7%; (Cu) = 4,3%.
- Sunteți aici:
- principal
- sarcini
- EGE-chimie
- Determinarea formulei de hidrocarburi moleculare în testele USE Sarcina 98
Trimiteți-le prietenilor: