Sistemele conjugate ciclice sunt de mare interes ca un grup de compuși cu stabilitate termodinamică crescută în comparație cu sistemele deschise conjugate. Acești compuși au alte proprietăți speciale, a căror totalitate este unită de conceptul general de aromatice. Acestea includ capacitatea unor astfel de compuși nesaturați formal să intre în reacții de substituție, mai degrabă decât adiții, rezistență la oxidanți și temperatură.
Reprezentanții tipici ai sistemelor aromatice sunt arenele și derivații lor. Caracteristicile structurii electronice a hidrocarburilor aromatice se manifestă în mod clar în modelul atomic-orbital al moleculei de benzen. Scheletul benzenic formează șase atomi de carbon sp2-hibridizați. toate Conexiunile (C-C și C-H) se află în același plan. Șase p-AO ne-hibridizate sunt perpendiculare pe planul moleculei și paralele unele cu altele (Figura 3, a). Fiecare p-AN se poate suprapune în egală măsură cu două p-AN adiacente. Ca urmare a acestei suprapuneri, există un singur sistem p-delocalizat, cea mai mare densitate electronică în care este deasupra și dedesubtul planului Scheletul acoperă toți atomii de carbon ai ciclului (vezi figura 3b). Densitatea electronului π este distribuită uniform pe întregul sistem ciclic, care este indicat de un cerc sau de o linie punctată în interiorul ciclului (a se vedea figura 3, c). Toate legăturile dintre atomii de carbon din inelul benzen au aceeași lungime (0,139 nm), intermediare între lungimile legăturilor unice și duble.
Pe baza calculelor mecanice cuantice, sa stabilit că pentru formarea unor astfel de molecule stabile un sistem ciclic planar trebuie să conțină (4n + 2) electronii π, unde n = 1, 2, 3 etc. (regula lui Hückel, 1931). Luând în considerare aceste date, conceptul de "aromaticitate" poate fi concretizat.
Sisteme aromatice (molecule) - sisteme care îndeplinesc criteriile de aromatizare:
1) prezența unui apartament # 983-schelet constând din atomi sp2-hibridizați;
2) delocalizarea electronilor, conducând la formarea unui singur n-electron de electroni care acoperă toți atomii ciclului (ciclurilor);
3) respectarea regulii lui E. Hückel; norul de electroni ar trebui să fie alcătuit din 4n + 2 p-electroni, unde n = 1,2,3,4 ... (de obicei cifra indică numărul de cicluri din moleculă);
4) grad ridicat de stabilitate termodinamică (energie de cuplare ridicată).
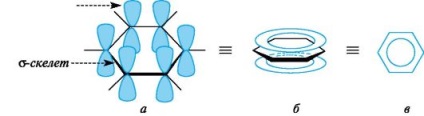
Fig. 3. Modelul atomic-orbital al moleculei de benzen (atomii de hidrogen sunt omise, explicații în text)
Stabilitatea sistemelor conjugate. Formarea unui conjugat și mai ales a unui sistem aromatic este un proces favorabil din punct de vedere energetic, deoarece în acest caz crește gradul de suprapunere a orbitalilor și are loc delocalizarea (dispersarea) electronilor p. În acest sens, sistemele conjugate și aromatice au crescut stabilitatea termodinamică. Acestea conțin o cantitate mai mică de energie internă și în starea solului ocupă un nivel de energie mai scăzut decât sistemele neconjugate. Prin diferența acestor niveluri, se poate estima cantitativ stabilitatea termodinamică a compusului conjugat, adică energia de conjugare (energia delocalizării). Pentru butadienă-1,3 este mică și se ridică la aproximativ 15 kJ / mol. Pe măsură ce lungimea lanțului conjugat crește, energia de conjugare și, în consecință, stabilitatea termodinamică a compușilor cresc. Energia de conjugare pentru benzen este mult mai mare și este de 150 kJ / mol.
Exemple de compuși aromatici nonbenzoici:
Pyridina este similară electronic cu benzenul. Toți atomii de carbon și atomul de azot se află în starea sp 2-hibridizare, și toți Conexiunile (C-C, C-N și C-H) se află în același plan (Figura 4, a). Dintre cele trei orbite hibride ale atomului de azot, două participă la formare
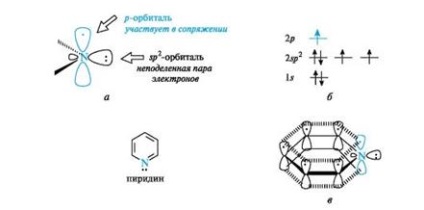
Fig. 4. atomul de azot al piridinei (a), distribuția electronilor în orbitale (b) și sistemul conjugat în moleculă de piridină (c) (legăturile C-H sunt omise pentru simplificarea figurii)
- conexiunile cu atomi de carbon (numai axele acestor orbite sunt arătate), iar cea de-a treia orbitală conține o pereche de electroni împărțită și nu participă la formarea legăturii. Un atom de azot cu o astfel de configurație electronică se numește piridină.
Datorită electronului localizat pe orbitele p-hibridizate (vezi figura 4, b), atomul de azot participă la formarea unui nor de electroni cu electroni φ de cinci atomi de carbon (vezi figura 4, c). Astfel, piridina este un sistem π, π-conjugat și satisface criteriile de aromatice.
Ca urmare a unei electronegativități mai mari comparativ cu atomul de carbon, atomul de azot din piridină scade densitatea electronilor la atomii de carbon ai inelului aromatic, deci sistemele cu un atom de azot de piridină sunt numite π-deficit. În plus față de piridină, un exemplu de astfel de sisteme este pirimidina conținând doi atomi de azot piridinici.
Pyrrolul se referă, de asemenea, la compuși aromatici. Atomii de carbon și azot din acesta, ca și în piridină, sunt în stare de hibridizare sp2. Cu toate acestea, spre deosebire de piridină, atomul de azot din pirol are o configurație electronică diferită (figura 5, a, b).
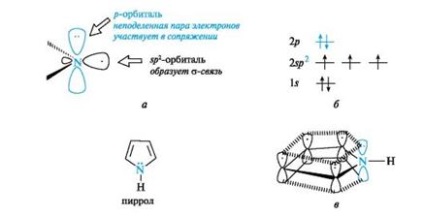
Fig. 5. Atomul de azot al pirolului (a), distribuția electronilor de-a lungul orbitalilor (b) și sistemul conjugat din molecula de pirol (c) (legăturile C-H sunt omise pentru simplitatea figurii)
O pereche de electroni neparticipați este localizată pe p-orbitalele nehybridizate ale atomului de azot. Participă la conjugarea cu electronii p de patru atomi de carbon pentru a forma un nor unic de șase electroni (a se vedea figura 5, c). Trei orbitali din sp 2-hibrizi Conexiuni - două cu atomi de carbon, unul cu un atom de hidrogen. Atomul de azot într-o astfel de stare electronică a fost numit pirol.
Un nor de șase electroni în pirol datorită p, n-conjugării este delocalizat la cinci atomi ai ciclului, prin urmare, pirolul este un sistem în exces.
În furan și tiofen, sextetul aromatic include, de asemenea, o pereche de electroni ne-împărțită, respectiv de oxigen p-AO neigridizat sau sulf. În imidazol și pirazol, doi atomi de azot contribuie în mod diferit la formarea unui nor de electroni delocalizați: atomul de azot din piroliță furnizează o pereche de electroni π și piridina furnizează un electron p.
O purină este, de asemenea, aromatică, care este un sistem condensat de două heterocicluri, pirimidină și imidazol.
Norul de electroni delocalizați din purină include 8 electroni p de legături duble și o pereche de electroni împărțită în comun de atomul N = 9. Numărul total de electroni în conjugare, egal cu zece, corespunde formulei Hückel (4n + 2, unde n = 2).
Compuși aromatici heterociclici au o stabilitate termodinamică ridicată. Nu este surprinzător faptul că ele servesc ca unități structurale ale celor mai importanți biopolimeri, acizi nucleici.
Trimiteți-le prietenilor: