Prin valoare calorică se înțelege căldura de ardere completă a unei unități de masă a materiei. Aceasta ia în considerare pierderile de căldură asociate cu disocierea produselor de ardere și incompletența reacțiilor chimice de combustie. Valoarea calorică reprezintă căldura maximă de ardere posibilă pe unitatea de masă a materiei.
Determinați valoarea calorică a elementelor, a compușilor acestora și a amestecurilor de combustibili. Pentru elemente, este numeric egal cu căldura de formare a produsului de ardere. Valoarea calorică a amestecurilor este o valoare aditivă și poate fi găsită dacă valoarea calorică a componentelor amestecului este cunoscută.
Arderea are loc nu numai datorită formării oxizilor, astfel încât, în cel mai larg sens se poate vorbi de elemente calorice și compușii lor sunt nu numai oxigen, ci și prin reacția cu fluor, clor, azot, bor, carbon, siliciu, sulf și fosfor.
Valoarea calorică este o caracteristică importantă. Aceasta face posibilă evaluarea și compararea cu ceilalți a eliberării maxime posibile de căldură a unei anumite reacții de reducere a oxidării și determinarea caracterului complet al cursului proceselor reale de combustie în raport cu acesta. Cunoașterea valorii calorice este necesară pentru alegerea componentelor combustibililor și a amestecurilor în diverse scopuri și pentru evaluarea caracterului complet al arderii.
Distingeți între valorile calorifice superioare H și HH inferioare. Valoarea calorifică mai mare, spre deosebire de cea inferioară, include căldura transformărilor de fază (condensare, solidificare) a produselor de ardere la răcire la temperatura camerei. Astfel, valoarea calorifică mai mare este căldura de combustie completă a substanței, atunci când starea fizică a produselor de ardere este considerată la temperatura camerei și cea mai mică - la temperatura de combustie. Valoarea calorică mai mare este determinată de arderea substanței într-o bomba calorimetrică sau prin calcul. Acesta include, în special, căldura eliberată în timpul condensării vaporilor de apă, care la 298 K este de 44 kJ / mol. Valoarea calorifică inferioară este calculată fără a lua în considerare căldura de condensare a vaporilor de apă, de exemplu prin formula
Dacă valorile valorii calorice indică starea fizică a produselor de ardere (solide, lichide sau gazoase), în acest caz, codurile „superior“ și „inferior“ sunt de obicei omise.
Luați în considerare valoarea calorică a hidrocarburilor și a elementelor în oxigen, pe unitatea de masă a combustibilului original. Valoarea calorică netă este diferită de parafine superioare de la o medie de 3220-3350 kJ / kg, de la olefine și naftene - pe 3140-3220kDzh / kg, din benzen - până la 1590 kJ / kg. La determinarea experimentală a valorii calorice trebuie amintit că această substanță este arsă într-un calorimetru cu bombă la un volum constant, și în condiții reale - de multe ori la o presiune constantă. Corecția pentru diferența dintre condițiile de ardere a combustibilului solid 2.1-12.6, păcurii - aproximativ 33,5, benzină - 46,1 kJ / kg, iar gazul ajunge la 210 kJ / m3. Practic, această corecție este introdusă numai atunci când se determină valoarea calorică a gazului.
În parafine, valoarea calorifică scade odată cu creșterea temperaturii de fierbere și cu creșterea raportului C / H. În hidrocarburile aliciclice monociclice, această schimbare este mult mai mică. În seria de benzen, valoarea calorică crește odată cu trecerea la omologi mai mari datorită lanțului lateral. Din această cauză, hidrocarburile aromatice dinucleare au o valoare calorică mai mică decât o serie de benzen.
Doar câteva elemente și compușii lor au o valoare calorică mai mare decât valoarea calorică a hidrocarburilor combustibile. Printre aceste elemente sunt hidrogen, bor, beriliu, litiu și compușii lor și câțiva compuși elementorganic de bor și beriliu. Valoarea calorică a elementelor, cum ar fi sulf, sodiu, niobiu, zirconiu, calciu, vanadiu, titan, fosfor, magneziu, siliciu și aluminiu, este în intervalul 9210-32 240 kJ / kg. Elementele rămase ale sistemului periodic al valorii calorice nu depășește 8374 kJ / kg. Datele privind valoarea calorifică mai mare a unei clase de combustibili diferite sunt prezentate în tabelul. 1.18.
Valoarea calorifică mai mare a diferitelor combustibili în oxigen (pe unitatea de masă a combustibilului) [36] [1]
Pentru hidrocarburile lichide, metanol și etanol, valoarea calorică este dată pentru starea inițială lichidă.
Valoarea calorică a unor combustibili a fost calculată pentru un calculator. Este de magneziu și aluminiu 24,75 31,08 kJ / kg (oxizi de stare - solidă) și substanțial coincide cu tabelul de date. 1.18. O valoare mai mare calorică a C26H54 parafină, S10H8 naftalină, antracen și hexamină S14N10 C6H12N4 este respectiv 47,00, 40,20, 39,80 și 29,80, iar cel mai mic - 43,70, 39,00, 38,40 și 28,00 kJ / kg.
De exemplu, cu referire la combustibilii cu rachete, vom da valorile calorifice ale diferitelor elemente în oxigen și fluor, pe unitatea de masă a produselor de ardere. Valorile calorifice sunt calculate pentru starea produselor de combustie la o temperatură de 2700 K și sunt prezentate în Fig. 1,25 și în tabelul. 1.19.
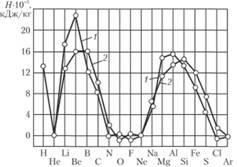
După cum rezultă din datele date, pentru obținerea căldurii maxime de ardere, cele mai preferate sunt substanțele care conțin hidrogen, litiu și beriliu și, în al doilea rând, bor, magneziu, aluminiu și siliciu. Avantajul hidrogenului datorat greutății moleculare mici a produselor de ardere este evident. Trebuie remarcat avantajul beriliului datorită valorii calorifice ridicate.
Este posibil să se formeze produse de combustie mixte, în special oxifluoruri de elemente gazoase. Întrucât elementele trivalente sunt de obicei stabile, cele mai multe oxifluoruri nu sunt eficiente ca produse de ardere pentru combustibilii rachetă datorită greutății lor moleculare înalte. Căldura de ardere cu formarea COF2 (g) are o valoare intermediară între valorile calorifice ale CO2 (g) și CF4 (g). Căldura de ardere cu formarea SO2F2 (g) este mai mare decât în cazul formării SO2 (g) sau SF6; (G). Cu toate acestea, majoritatea combustibililor din rachete conțin elemente cu capacitate mare de reducere, care împiedică formarea unor astfel de substanțe.
Formarea oxifluorurii de aluminiu AlOF (g) produce mai puțină căldură decât formarea de oxid sau fluorură, deci nu este de interes. Oxyfluorura de bor BOF (g) și trimerul său (BOF) 3 (g) sunt componente importante ale produselor de combustie ale combustibililor rachetă. Căldura de combustie cu formarea BOF (g) are o valoare intermediară între căldura de ardere pentru a forma oxid și fluorură, oxifluorura este termic mai stabilă decât fiecare dintre acești compuși.
Încălzirea arderii elementelor (în MJ / kg), raportată la masa produselor de combustie (T = 2700 K)
Trimiteți-le prietenilor: