Apa este o substanță uimitoare și unică
Apa din jur este o substanță cu proprietăți unice, care nu numai că nu sunt pe deplin explicate, dar nu toate sunt cunoscute. Nu există nici o substanță mai surprinzătoare și mai misterioasă decât apa obișnuită. Proprietățile sale nu se supun legilor inerente majorității substanțelor care ne înconjoară, cauzate de unicitatea structurii moleculei de apă.

Moleculele de apă au o disimetrie: partea oxigenată a moleculei are o încărcătură negativă, iar partea hidrogenului - una pozitivă. Ele sunt deplasate unul față de celălalt, prin urmare molecula de apă este un dipol electric și, în același timp, are un moment magnetic. Disponibilitate asimetrie spațială permite moleculei de legare a apei împreună în diferite moduri pentru a forma un structuri complexe și variate foarte stabile - clustere care apar în solid sau lichid și chiar gazos apă de stat. Iată câteva exemple de proprietăți speciale ale apei.
Apa - cel mai puternic solvent natural: în apă toate substanțele se dizolvă în grade diferite. De fiecare dată, de exemplu, băut un pahar de ceai fierbinte, împreună cu el bem 0,1 miligrame de sticlă dizolvată în el. Apa are un moment înalt de dipol și, ca rezultat, o constantă dielectrică unică, cea mai mare dintre toate lichidele! De îndată ce ionul oricărei substanțe intră în apă, este imediat acoperit de o carapace hidratată, formând un "atom gigantic". Alchemistii nu spun nimic: "Substanțele nu reacționează una cu cealaltă, cu excepția unei forme lichide" (adică în soluție apoasă). Când substanțele solubile intră în apă, ele, datorită proprietăților apei, sunt împărțite intensiv în particule mai mici, până la molecule și ioni. Sunt obținute particule de substanțe dizolvate, care sunt implicate în diferite reacții chimice.
Apa este una dintre cele mai misterioase substanțe ale planetei noastre. Fiind un compus monomolecular normal, ar trebui să fiarbă la +70 ° C și să înghețe la aproape -100 ° C. Spre deosebire de toate celelalte lichide, apa la întărire își reduce greutatea. Densitatea maximă a apei are loc la + 4 ° C. Acest fapt este extrem de important pentru biosferă. Ca rezultat, gheața formată pe suprafața corpurilor de apă, împiedicându-le congela la partea de jos, și, astfel, prevenind peștii mor și alți reprezentanți ai faunei acvatice în timpul iernii.
Tensiunea superficială a apei pure este mai mare decât cea a oricărui alt lichid, cu excepția mercurului. În apa absolut pură, tensiunea superficială este de așa natură încât ar fi posibil să-i schițeze. Prezența impurităților reduce brusc valoarea tensiunii superficiale a apei. Una dintre "ciudățenia" apelor este că această substanță - singura pe Pământ - apare întotdeauna în trei "fețe" - lichide, solide și gazoase.
Solvenții sunt, de regulă, fie acizi, fie alcali. Numai apa (OH- și OH +) prezintă proprietăți, atât acizi cât și baze. Gradul de aciditate sau alcalinizare a oricărei soluții este măsurat prin valoarea pH-ului, care variază de la 0 pentru acidul la 14 pentru alcaline. Balanța neutră a acidului-bază în apă, atunci când numărul de ioni pozitivi și negativi este egal, corespunde la pH = 7. Cu cât pH-ul este mai scăzut, cu atât este mai acidă reacția mediei și cu atât mai puternice sunt proprietățile sale de aciditate. O apă cu un pH de 6-8 este considerată normală. La pH = 3-6, reacția este slab acidă. La pH = 8-11 - ușor alcalin. Valorile echilibrului acido-bazic al sângelui unei persoane sănătoase variază în limite foarte înguste la pH = 7,35-7,45. Orice deviere este o patologie. Scăderea pH-ului sub 7,35 conduce la acidifiere (acidoză) și la peste 7,45 la alcalinizarea (alcaloza) a organismului. Schimbarea (sub 6,8 și peste 7,8) duce la perturbări grave ale bolii. Apropo, apa potabilă este cea mai utilă pentru apă cu aceleași valori ale pH-ului ca și sângele normal, deși pot exista abateri.
Iată valorile pH ale unor medii de interes:
Saliva 5,8 - 7,4; sucul gastric 1,5 - 1,8; lapte 6,6; cafea 5; bere 4,5 - 5; suc de roșii 4,6; suc de portocale 3,7; oțet alimentar 3; suc de lamaie 2,4.
Apa foarte pură din capilară îngheață la -70 ° C. Când decongelare apă rece ca gheața păstrează structura sub formă de fragmente (clustere) sunt foarte lungi, până la punctul de fierbere al căldurii latente de topire a apei - cea mai mare dintre toate substanțele, cu excepția amoniac și hidrogen, iar căldura latentă de evaporare - cea mai mare dintre toate substanțele. Capacitatea specifică de căldură este de asemenea cea mai mare, cu excepția amoniacului lichid și a hidrogenului. Este de aproximativ zece ori mai mare decât cea a pietrelor.
În lume, aparent, nu există două fulgi de zăpadă absolut identici. Fiecare moment al timpului, fiecare punct al spațiului, în același timp, poartă propriile informații unice, pe care fulgul de zăpadă îl percepe și fixează în structura sa. Fiecare fulg de zăpadă, care cade la pământ, trece prin straturi de aer, care diferă în funcție de umiditate, temperatură, poluare și alți parametri. Prin urmare, printre milioane de fulgi de zăpadă, este foarte greu de găsit două complet identice.
Ca fulgi de zăpadă de diverse forme, îngheț, îngheț pe geamuri - apa de cristal solid, astfel încât chiar și mai surprinzător forme diverse și proprietăți de cristale lichide care constituie apa lichidă.
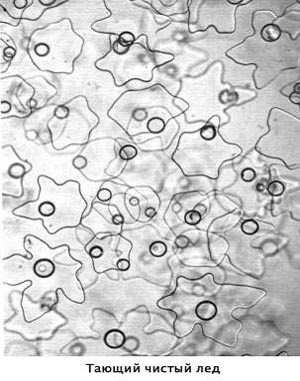
Figura prezintă fotografii (Jill Walker), topirea gheții și forme tipice de cristale formate în congelarea apei pure. În gheața topită, clustele sunt vizibile clar, care, deformate și schimbând forma, rămân în apă lichidă, până la punctul de fierbere. Chiar și vaporii de apă constau nu numai din molecule individuale, ci 10% din diferite structuri mai complexe.
"Apă greu". În apa grea, tot hidrogenul este înlocuit cu deuteriu. Nici în culoare, nici în gust, nici în miros, nu diferă de apa obișnuită. Dar proprietățile sale fizice sunt oarecum diferite. Se îngheață la 3,8 ° C, se fierbe la 101,4 ° C. Ca urmare a acestor diferențe, apele naturale de origine diferită diferă în compoziția izotopică. Acesta este rezultatul evaporării repetate și condensării în timpul circulației apei. Raportul mediu în apele naturale de apă grea și apă este de obicei 1/6000. Greutatea specifică a apei grele este cu zece procente mai mare decât cea a apei obișnuite. Spre deosebire de apa obișnuită, apa grea are o densitate maximă de + 11,6 ° C
La un moment dat în presă, au existat multe publicații despre apa "vie" și "moartă", despre metodele de obținere a acestora, despre acțiunile biologice și despre utilizări. Fără să ne referim în detaliu la această problemă, observăm doar că ambele tipuri de apă sunt obținute prin electroliza apei și diferă în funcție de pH. „Apă mort“ (anolit) are un mediu acid si are un dezinfectant puternic efect de sterilizare este utilizat pentru tratarea ulcerelor, plăgi puroi, boli de piele. „Apa“ (catolit) are un mediu alcalin și este un puternic biostimulator, îmbunătățește activitatea celulelor, favorizează eliminarea toxinelor și îmbunătățește mecanismele de apărare ale organismului. Ambele înseamnă că atât apa "vie" cât și cea "mortă" sunt agenți puternici și necesită prudență și experiență pentru aplicarea lor.
Rezultatele interesante sunt obținute prin utilizarea apei de degazare pentru apa potabilă, a apei care conține jumătate din gazele dizolvate în ea, ca în cazul lichidelor din obiecte biologice. Îmbunătățește metabolismul celular, stimulează procesele fiziologice. Spălarea cu astfel de apă îmbunătățește calitatea pielii.
Problema temperaturii de 37 de grade în lumea animalelor este încă în discuție. După cum știm, atunci când orice substanță este încălzită, capacitatea sa de căldură crește. Oricine, cu excepția apei: atunci când este încălzit de la 0 la 37 de grade, capacitatea de căldură scade și doar cu încălzire continuă începe să crească. Acest fapt înseamnă că la o temperatură de 36-37 de grade, este necesară o cantitate minimă de căldură pentru a crește temperatura unui anumit volum de apă. Aparent, această proprietate a apei a fost factorul selectiv al evoluției în dezvoltarea sângelui cald la nivelul de 37 de grade Celsius. O creștere a temperaturii este necesară pentru a crește intensitatea cursului proceselor biologice.
Trimiteți-le prietenilor: