Alcani sunt hidrocarburi în ale căror molecule atomii sunt legați prin legături simple și care corespund formulei generale CnH2n + 2.
În moleculele de alcani, toți atomii de carbon sunt în stare de sp3-hibridizare. Aceasta înseamnă că toate cele patru orbite hibride ale atomului de carbon sunt identice în formă, energie și sunt direcționate către unghiurile unei piramide triunghiulare echilaterale - un tetraedru. Unghiurile dintre orbitale sunt 109 ° 28 '.
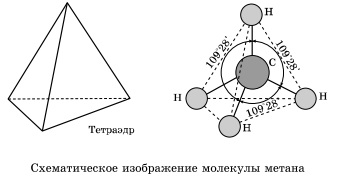
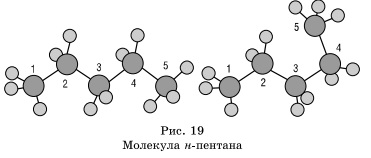
În jurul unei singure legături carbon-carbon poate rotație practic liber, iar moleculele de alean pot dobândi forma cele mai diverse cu colțuri la atomul de carbon cel mai apropiat de tetraedrice (109 ° 28 „), de exemplu, n -pentan în moleculă.
Merită amintit despre legăturile din moleculele de alcani. Toate legăturile din moleculele de hidrocarburi saturate sunt simple. Suprapunerea are loc pe axă,
care conectează nucleele de atomi, adică sunt legături σ. Legăturile carbon-carbon sunt nepolar și slab polarizabile. Lungimea legăturii C-C în alcani este de 0,154 nm (1,54 x 10-10 m). Legătura dintre CN este oarecum mai scurtă. Densitatea electronului este ușor deplasată spre atomul de carbon mai mult electronegativ, adică legătura C-H este slab polară.
Absența legăturilor polare în moleculele de hidrocarburi limitativ duce la faptul că acestea sunt slab solubile în apă, nu interacționează cu particulele încărcate (ioni). Cele mai caracteristice pentru alcani sunt reacțiile care au loc cu participarea radicalilor liberi.
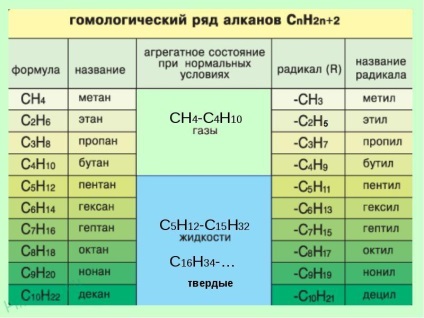
Serii omogene de metan
Homologii sunt substanțe care sunt similare în structură și proprietăți și diferă în una sau mai multe grupări CH2.
Izomerismul și nomenclatura
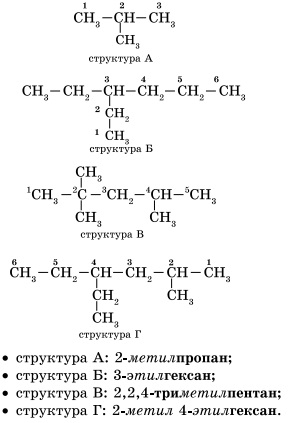
Pentru alcani, așa-numitul izomerism structural este caracteristic. Izomerii structurali diferă unul de celălalt în structura scheletului de carbon. Cel mai simplu alcan, caracterizat prin izomeri structurali, este butanul.
Noțiunile fundamentale ale nomenclaturii
1. Selectați circuitul principal. Formarea denumirii hidrocarburilor începe cu definirea lanțului principal - cel mai lung lanț de atomi de carbon din moleculă, care este, ca atare, baza sa.
2. Numerotarea atomilor principali ai lanțului. Atomii lanțului principal sunt numere atribuite. Numerotarea principalilor atomi în lanț pornește de la capătul la care este mai aproape substituentul (structura A, B). Dacă substituenții sunt echidistant față de capătul lanțului, apoi numerotare începe de la sfârșitul anului la care există mai multe (structura B). Dacă diferiți substituenți sunt echidistant față de capetele lanțului, numerotarea începe de la capătul greșit, care este mai aproape de senior (structura D). substituenții de hidrocarburi precedență este determinată de ordinea în care rezultă litera din alfabet, care începe numele lor: metil (-CH3), apoi etil (-CH2-CH3), propil (CH2-CH2-CH3), etc ...
Rețineți că numele substituentului este format prin înlocuirea sufixului -an cu sufixul -il în numele alcanului corespunzător.
3. Formarea numelui. La începutul numelui indică numere - numărul de atomi de carbon, în care substituenții sunt. Dacă la un anumit atom sunt mai mulți substituenți, numărul corespunzător din titlu se repetă de două ori separate prin virgulă (2,2). După numerele indică numărul despărțite în silabe substituenților (di - doi, trei - trei, tetra - patru, penta - cinci) și numele substituenților (metil, etil, propil). Apoi, fără spații și cratime, numele lanțului principal. Circuit principal numit ca o hidrocarbură - un membru al seriei omoloage de metan (metan CH4 etanului C2 H6 propan C3 H8 Butan C4 H10, panten C5 H12 hexanul C6 H14 Heptan C7 H16, octane C8 H18, nonanul C9 H20, decan C10 H22 .....) .
Proprietățile fizice ale alcanilor
Primii patru reprezentanți ai seriei omogene de metan sunt gazele. Cel mai simplu dintre ele - metan - gaz fără culoare, gust si miros (miros senzație de „gaz“, care este necesar pentru a apela 04 se determină mirosul de mercaptani - a adăugat în mod deliberat compuși ai sulfului în metan utilizate în aparatele de gaz casnice și industriale oamenilor , care se află lângă ele, ar putea detecta o scurgere prin miros).
Hidrocarburi cu compoziție de la C4H12 la C15 H32 - lichide; hidrocarburile mai grele sunt solide. Temperaturile de fierbere și topire ale alcanilor cresc treptat cu creșterea lungimii lanțului de carbon. Toate hidrocarburile sunt slab solubile în apă, hidrocarburile lichide sunt solvenți organici obișnuiți.
Proprietăți chimice ale alcanilor
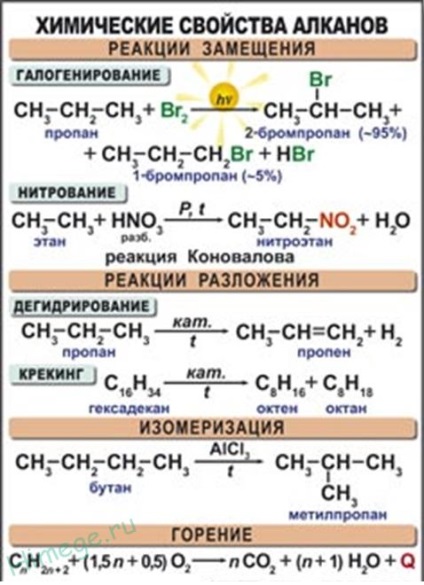
Reacții de substituție.
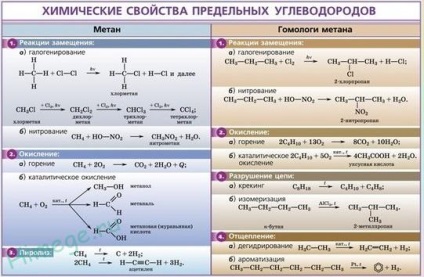
Cele mai caracteristice pentru alcani sunt reacțiile de substituție cu radicali liberi, în timpul cărora atomul de hidrogen este înlocuit cu un atom de halogen sau un grup. Dăm ecuațiile reacțiilor caracteristice de halogenare:

În cazul unui exces de halogen, clorurarea poate merge mai departe, până la înlocuirea completă a tuturor atomilor de hidrogen cu clor:
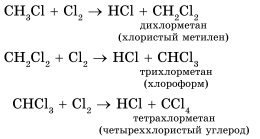
Substanțele obținute sunt utilizate pe scară largă ca solvenți și materii prime în sinteze organice.
Reacția dehidrogenării (eliminarea hidrogenului).
In timpul alcanilor transmisie peste catalizator (Pt, Ni, CR2 A12 03. 03) la temperaturi ridicate (400-600 ° C) a moleculei de hidrogen se scindează și formarea de alchene:
Reacțiile însoțite de distrugerea lanțului de carbon.
Toate hidrocarburile terminale ard cu formarea de dioxid de carbon și apă. Hidrocarburile gazoase amestecate cu aer în anumite raporturi pot exploda.
1. Arderea hidrocarburilor finale este o reacție exotermică a radicalilor liberi, care este foarte importantă atunci când se utilizează alcani drept combustibil:
În general, reacția alcanilor arzători poate fi scrisă după cum urmează:
2. Despicarea termică a hidrocarburilor.
Procesul trece printr-un mecanism al radicalilor liberi. O creștere a temperaturii conduce la o ruptură homolitică a legăturii carbon-carbon și la formarea radicalilor liberi.
Acești radicali interacționează unul cu celălalt, schimbând atomul de hidrogen, pentru a forma o moleculă de alcan și o moleculă de alchenă:
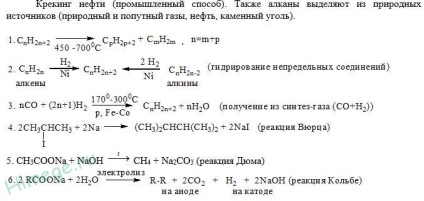
Reacțiile de descompunere termică subliniază procesul industrial - fisurarea hidrocarburilor. Acest proces este cea mai importantă etapă a rafinării petrolului.
3. Piroliza. Când metanul este încălzit la 1000 ° C, începe piroliza metanului - descompunerea în substanțe simple:
Când este încălzit la 1500 ° C, acetilena poate forma:
4. Izomerizarea. Când hidrocarburile lineare sunt încălzite cu un catalizator de izomerizare (clorura de aluminiu), se formează substanțe cu un schelet de carbon ramificat:
5. Aromatizarea. Alcani cu șase sau mai mulți atomi de carbon în lanț în prezența unui catalizator sunt ciclizați pentru a forma benzen și derivații săi:
Alcanii intră în reacții care se desfășoară de-a lungul mecanismului radicalilor liberi, deoarece toți atomii de carbon din moleculele de alcani sunt în stare de hibridizare sp3. Moleculele acestor substanțe sunt construite cu ajutorul legăturilor covalente C-C covalent (carbon-carbon) și legăturilor C-H (carbon-hidrogen) slab polar. Ei nu au zone cu densitate electronică ridicată și scăzută, legături ușor polarizabile, adică astfel de legături, densitatea electronică în care poate fi deplasată de factori externi (câmpuri electrostatice de ioni). În consecință, alcani nu vor reacționa cu particulele încărcate, deoarece legăturile din moleculele de alcani nu sunt rupte de mecanismul heterolitic.
Metode de obținere

Articole similare
-
Structura atomului și proprietățile chimice ale elementelor - stadopedia
-
De ce sunt proprietățile magice și chimice negre de argint ale metalului
Trimiteți-le prietenilor: