Oxizi și acizi de fosfor. Fosforul formează trei compuși cu oxigen: P2O3 - anhidrida fosforică, P2O5 - anhidrida fosforică și tetraoxidul de fosfor P2O4.
Anhidrida P2O3 fosforică se obține prin oxidarea lentă a fosforului sau în cazul în care fosforul arde cu acces insuficient la oxigen. Este o substanță cristalină albă, topită la 23,8 ° și fierbere la 173 °. Greutatea sa moleculară la temperaturi scăzute corespunde formulei P4O6. Sub acțiunea apei reci, anhidrida fosforică se leagă încet cu ea, formând un acid fosforos H3PO3. Atât anhidrida fosforică, cât și acidul fosforos au proprietăți de reducere puternică.
Anhidrida fosforică P2O5 se formează la arderea fosforului în aer sau în oxigen sub formă de masă albă, asemănătoare zăpezii, topind la 563 °. Densitatea vaporilor săi corespunde formulei P4O10.
Anhidrida fosforică se combină cu lăcomie cu apă și, prin urmare, este utilizată ca un bun agent de deshidratare. Poate chiar să ia elemente de apă din alți compuși, de exemplu din acizi sulfurici și azotați. În aer, anhidrida fosforului, care atrage umiditatea, se răspândește rapid, transformându-se într-o masă lipicioasă de acid metafosforic.
Structura moleculelor de anhidride fosforice și fosforice poate fi exprimată prin următoarele formule structurale:
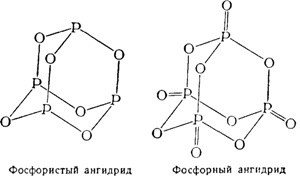
Tetraoxidul de fosfor P2O4 este un cristal lucios incolor. Acest oxid, ca N2O4, poate fi considerat ca o anhidridă mixtă. Când se dizolvă în apă, se formează cantități echimoleculare de acizi fosforici și fosfor:
Acizi fosforici. Anhidrida fosforică, în funcție de temperatură, poate atașa o cantitate diferită de apă, formând acizi meta-, piro- și ortofosforici:
Când dizolvat pentoxid de fosfor în apă rece format acidul metafosforic, cea mai simplă formulă care NRO3; De fapt, structura sa moleculară exprimată prin formula (NRO3) x, unde, 5, 6, și așa mai departe. D. Prin evaporarea soluției de acid metafosforic este izolat x = 3, 4, ca o masă sticloasă, ușor solubil în apă.
Acidul metafosforic este foarte toxic. Sărurile acidului metafosforic sunt utilizate pentru a înmuia apa.
Dacă se fierbe o soluție de acid metafosforic, se atașează molecule de apă și se formează H3PO4 acid trifosforic.
Acidul orfosforic H3P04 formează cristale transparente incolore, topiind la 42 ° C. În apă, se dizolvă foarte bine.
Acidul ortofosforic nu este otrăvitor.
După încălzirea acidului ortofosforic în stare uscată, la 215 ° din fiecare din cele două molecule sale clivate și o moleculă de apă se obține acidul pirofosforic tetrabazic sub formă de masă sticloasă solubilă în apă:
Dintre cei trei acizi numiți, cel mai important este acidul ortofosforic, care este denumit de obicei acid fosforic.
Acidul ortofosforic poate fi obținut nu numai prin fierberea unei soluții de acid metafosforic, ci prin oxidarea fosforului roșu cu acid azotic:
În scopuri tehnice, acidul ortofosforic se obține în principal prin acțiunea acidului sulfuric pe fosfat de calciu:
Sulfatul de calciu rezultat este aproape insolubil în apă, astfel încât soluția de acid fosforic poate fi ușor separată de el și condensată prin evaporare.
Acidul fosforic este un acid de putere medie. Constanta sa de disociere este de 7,5 · 10 -3. Într-o soluție apoasă, acidul fosforic disociază predominant în ioni de H și H2 PO4 '
Ca acid tribazic, acidul ortofosforic formează trei serii de săruri: săruri normale, săruri acide cu un atom de hidrogen în reziduu acid și sărurile acide la doi atomi de hidrogen din fragmentul de acid. Sărurile normale ale acidului fosforic se numesc fosfați, acid - hidrogenfosfat.
Toate fosfații primari sunt solubili în apă; Numai fosfații de sodiu, potasiu și amoniu sunt solubili din cele secundare și terțiare.
Știi cum
Trimiteți-le prietenilor: