Moleculele homonucleare diatomice [c.49]
Moleculele Oj, Nj și I2, constând din atomi de un singur tip, se numesc homonucleari. În contrast, astfel de molecule. ca, de exemplu, HCI, CO sau HI, se numesc heteronucleare. Să încercăm să extindem abordarea simplă descrisă mai sus la luarea în considerare a moleculelor H și H, bazate pe teoria orbitalelor moleculare. pe moleculele diatomice homonucleare ale elementelor din a doua perioadă. Unele dintre aceste molecule. de exemplu, Nj, Oj și Fj, sunt stabile în condiții normale. Altele, de exemplu C sau Lij, sunt detectate numai la temperaturi ridicate. și încă nu există altele. După cum se explică prin aceste fapte, teoria orbitalelor moleculare [c.520]
În interacțiunea atomilor se formează molecule omonucleare (în interacțiunea atomilor unui element) sau molecule heteronucleare (în interacțiunea atomilor de elemente diferite). [C.17]
Umplerea orbitalilor de electroni se efectuează exact în același mod ca în cazul moleculelor homonucleare. Moleculele YO sunt izoelectronice cu C2, diferența dintre ele este în principal că nivelurile și [c.538]
Este ușor de observat că aceste combinații sunt independente liniar. Luați în considerare combinațiile XI și 2. După cum se poate vedea din fig. 4.3, funcțiile rezultate apar ca p-AO modificate cu o lamă mare și una mică în X1 și / 2 lame mari orientate de-a lungul celor două axe în direcții opuse. Presupunem că molecula luată în considerație este homonucleară, astfel încât în aproximarea Hückel ambele 2s-AOs au aceeași informație Coulomb [
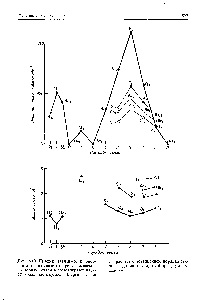
Structura electronică homonucleare moleculelor diatomice este determinată de procesul mental de umplere electroni de valență ale orbitali moleculare. începând de la, și terminând cu a. în ordinea ascendentă a energiei. Astfel, este posibil să se stabilească, de exemplu, că molecula N2 are CC configurație electronică (a) (una o legătură), iar molecula N2 are o QA configurație (a,) (v) (Aq. Y) (a,) cu trei eficiente conexiuni (o st-bond și două n-link-uri). Numărul efectiv de electroni de legare împărțiți la 2 dă ordinea obligațiunilor condiționate. De exemplu, ordinea de N2 molecule de conectare 1, și N3 este ordinul de legătură 3. Cu ordinea crescătoare a comunicării într-un sistem de comunicație predeterminat homonucleare diatomic scade lungimea sa și energia de legare crescută. [C.544]
Setul de stări posibile de rotație depinde de faptul dacă molecula este homonucleară H. O) sau heteronucleară (HCI). Prin urmare, considerăm ambele cazuri separat. [C.246]
Singura oscilare posibilă într-o moleculă diatomică este mișcarea atomilor de-a lungul axei care unește ambele nuclee. Dacă molecula este homonucleară (O2, I2 etc.), este evident că centrele încărcărilor pozitive și negative coincid în toate fazele oscilației, iar momentul dipolului este întotdeauna zero. Vibrațiile unor astfel de molecule nu sunt însoțite de absorbția radiațiilor infraroșii și sunt numite inactive în spectrul infraroșu. Pe de altă parte, dacă atomii din moleculă sunt diferiți (HCI, CO, etc.), distribuția electronilor se schimbă odată cu vibrația legăturii de valență. În acest caz, centrele de încărcări pozitive și negative nu coincid întotdeauna, ca urmare a modificării momentului dipolului. Astfel de oscilații se numesc active. Ei pot interacționa cu radiațiile electromagnetice, transpirația [c.13]
Fig. 3. Relaxarea funcțiilor de undă (a) și a legăturilor (b) ale unei molecule diatomice homonucleare

Analiza structurii electronice a moleculelor diatomice heteronucleare din forma generală AB se realizează într-o manieră similară celei pentru moleculele homonucleare. În ambele cazuri, se obțin diagrame de energie orbitală similare. numai cu diferența că nivelele orbitale ale atomului mai electronegativ sunt localizate mai adânc decât atomul mai puțin electronegativ (Figurile 12-13). În consecință, orbalii moleculare obligatorii conțin contribuția predominantă a atomului mai electronegativ. și slăbirea orbital-predominant- [c.537]
De ce imaginile orbitalilor pentru o moleculă diatomică heteronucleară în Fig. 12-14 diferă de imaginile corespunzătoare pentru moleculele diatomice homonucleare din Fig. 12-7 [c.546]
Ce molecule diatomice sunt numite homonucleare și care sunt heteronucleare [c.545]
În majoritatea covârșitoare a cazurilor, termenul principal al unei molecule diatomice este o moleculă homonucleară. Există excepții, de exemplu [c.198]
Entropia crește deoarece moleculele de produs sunt mai complexe (ele sunt heteronucleare) decât moleculele reactivilor (homonucleari). Cu toate acestea, această creștere a entropiei este mică. [C.532]
Mai jos, ca exemplu considerăm moleculele care aparțin unui grup de simetrie punct Acestea includ toate homonucleare dihidroxilic și structură liniară polihidroxilic heteronuclear cu centrul de inversiune HC CH, C = 0 și m = 0. D. [C.192]
Figura 1. Aranjarea relativă a orbitalilor moleculari de-a lungul enmes-urilor moleculelor diatomice homonucleare fără interacțiunea a, - și-MO (a) și cu interacțiunea (b) [c.11]
Cartea este o cuprinzătoare și ușor de înțeles, și cel mai important punct de vedere metodologic corect introduce teoria legăturii chimice și rezultatele aplicării sale la descrierea structurii și proprietăților compușilor din diferite clase. În primul rând a prezentat idei de pre-cuantice J. Lewis de valență (Lewis ovyh) structuri și arată că deja pe baza reprezentărilor despre socializarea perechilor de electroni și o regulă octetul simplă prin utilizarea raționamentului logic despre multitudinea de relații și a taxelor formale este posibilă fără calcule matematice complexe, cum se spune pe degete. explică structura și proprietățile multor molecule. În esență, acest lucru începe cu introducere în chimia modernă pătrunde în toate punctele de vedere și termenii uneia dintre cele două abordări principale ale teoriei cuantice a structurii chimice, metoda de legături de valență (BC). Din păcate, în ciuda simplitatea și recursul intuitivă a acestor idei, metoda soarelui este foarte complicată și computational nu permite calitativ pentru a rezolva problema energiei stărilor electronice ale moleculelor. fără de care este imposibil să se judece structura lor. Prin urmare, teoria cuantică a legăturilor chimice este descrisă în principal în cadrul unei alte abordări, metoda orbitală moleculară (MO). În exemplul de molecule biatomice a intrat teoria cheie de reprezentare OM de suprapunere și de nivelurile de energie orbitale ale MO, caracterul lor obligatoriu și proprietăți nodale. precum și simetria MO. Toate aceste construcții se termină diagrame generalizate pentru MO și molecule biatomice homonucleare Goethe -royadernyh discuții și cu ajutorul lor structura și proprietățile multor sisteme specifice în același timp devine clar că unele dintre proprietățile moleculelor (de exemplu, magnetice) pot fi explicate numai pe baza teoriei cuantice MO. Mai mult, teoria MO este aplicată moleculelor poliatomice. și, în unele cazuri, aceasta se face în termeni de MO localizate (similar cu ideea direcția metodei legăturilor de soare) și proiectarea lor este introdus hibridizării orbitalilor atomici. iar în altele, trebuie să se întoarcă la MO delocalizat. Discutarea acestor probleme se termină secțiunea interesantă scrisă a posibilităților de spectroscopie moleculara la determinarea structurii compușilor principiilor aici sunt explicate spectroscopiei vibraționale [C.6]
Pentru substanța diatomic homonucleare sumă de rotație peste stări Q = 50. Se calculează pentru nivele 1) raportul dintre numărul de molecule la nivelul kth pentru numărul de molecule la nivelul zero 2) fracția (din total) molecule care sunt la nivelul 1 3) fracția de molecule la nivelul zero. [C.123]
Schema () prezintă etapele succesive ale complicării organizării chimice a materiei (este firesc ca această schemă să fie și un fragment al structurii generale a organizării materiei, adică continuarea schemei). Din schema 2 se poate observa că asociații moleculari sunt formați din molecule homonucleare sau hetero-nucleare, în timp ce asociații atomici sunt formați din particule atomice. ocolind al doilea nivel molecular. Formarea agregatelor atomice poate apărea deja prin două mecanisme independente, fie direct din particule atomice (ocolind două nivele), fie prin interacțiunea asociatelor atomice. Cele mai tipice exemple de agregate atomice sunt laturile atomice și cristaline metalice [c.9]
Acum începem să popularea cu electroni succesiv orbitali molecular fursecuri doi electroni orbitali și clarifica structura electronica a moleculelor diatomice homonucleare la Li2 N62-, astfel, toate aceste molecule are în principal patru electroni, care au fost atomi izolate pe interior 15-orbitali 51H. In molecula diatomice, doi dintre cei patru electroni interni sunt la a1 legare molecular orbital și cele două orbitalii și antibonding pe. Totuși, acești patru electroni nu au niciun efect asupra legăturii chimice. și, prin urmare, putem presupune că aceștia se află încă pe 1 orbitali atomici. Liantul chimică în moleculele luate în considerare aici este definită numai electronii exteriori cu nivel atomic cu numărul n = 2 cuantic, deci este necesar să se ia în considerare numai acele orbitali moleculare. care sunt formate de atomi 2s și 2p orbitali. [C.525]
Pătraturile acestor funcții determină distribuțiile densității electronice. corespunzând fiecărei orbitale moleculare. Toate orbitele moleculare sunt prezentate schematic în Fig. 13-25. Trei dintre ele sunt obligatorii, iar trei se slăbesc. Nivelurile lor de energie sunt prezentate în Fig. 13-26. Observăm că regula generală este ilustrată de exemplul n-orbitalilor luați în considerare. conform căruia orbitele cu un număr mare de suprafețe nodale au o energie mai mare. Valabilitatea acestei afirmații poate fi verificată pe orbitele moleculelor diatomice homonucleare și heteronucleare. discutat în Ch. 12, și chiar pe funcțiile de undă ale atomului de hidrogen. [C.575]
În oraș. 12 am discutat structura electronică a HCl și am observat că moleculele diatomice heteronucleare sunt polare, în timp ce moleculele de două atomi homonucleare sunt nepolare. O moleculă nepolară are un moment dipol zero (sau aproape zero). Dintre moleculele poliatomice există multe taki.x în care legăturile individuale sunt polare. deși molecula ca întreg este nepolară. De exemplu, menționăm SSS. Structura moleculei este lj. este prezentat în Fig. 13-28, a. Deoarece clorul este mai mult electronegativ. decât carbonul, perechile de electroni de legare sunt deplasate către atomii de clor. Ca rezultat, fiecare conexiune CC obține un moment mic al dipolului. Adăugarea în perechi a vectorilor de dipoli de legături oferă două egale în mărime și invers în direcția fragmentelor de dipol CC1. așa cum se arată în figurile 13-28, b. Forma simetrică tetraedrică a moleculelor CCC provoacă un moment dipol zero în acest fel, I4 este o moleculă nepolară. [C.579]
Valence și structura moleculelor (1979) - [p.66. c.72]
Articole similare
Trimiteți-le prietenilor: