Elementele toxice (în special, unele metale grele) constituie un grup extins de substanțe toxice. În mod normal, sunt considerate 14 elemente: Hg, Pb, Cd, As, Arsenic, Sb, Sn, Zn, Al, Be, Fe (fier), Cu (cupru), Ba (bariu), Cr (crom), Tl (taliu). Desigur, nu toate elementele enumerate sunt otrăvitoare, unele dintre ele fiind necesare pentru activitatea vitală normală a oamenilor și a animalelor. Prin urmare, este adesea dificil să se traseze o linie clară între substanțele biologice necesare și substanțele nocive pentru sănătatea umană.
În majoritatea cazurilor, punerea în aplicare a unui anumit efect depinde de concentrare. Cu o creștere a concentrației fiziologice optime a elementului în organism, poate să apară intoxicație. iar deficiența multor elemente din alimente și apă poate duce la fenomene destul de severe și dificil de recunoscut de insuficiență.
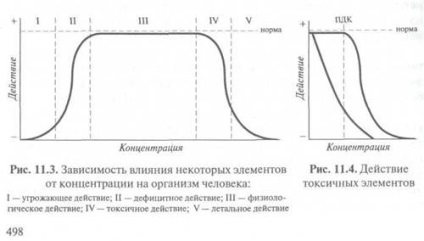
Dependența efectului dăunător sau util al anumitor elemente asupra concentrației este prezentată în Fig. 11.3.
Pentru substanțele care aparțin așa-numitului supertoxicants platou caracterizează norma, nu există (sau foarte scurt), iar panta ramurii descendente caracterizează toxicitatea unei substanțe (Fig. 11.4).
Poluarea corpurilor de apă, a atmosferei, a solului, a plantelor agricole și a produselor alimentare cu metale toxice se datorează:
- emisiile de întreprinderi industriale (în special cărbune, industria metalurgică și chimică);
- emisii de transport urban (ceea ce înseamnă contaminare cu plumb din arderea cu benzină cu plumb);
- utilizarea în producția de conserve de acoperiri interioare substandard și în încălcarea aliajelor de tehnologie;
- contactul cu echipamentul (în scopuri alimentare este permis un număr foarte limitat de oțeluri și alte aliaje).
Pentru majoritatea produselor, concentrațiile maxime admise (MPC) ale elementelor toxice au fost stabilite, iar cerințele mai stricte sunt impuse produselor pentru copii și dietetice.
Cele mai periculoase dintre elementele de mai sus sunt mercurul (Hg), plumbul (Pb), cadmiul (Cd).
Mercury - .. Unul dintre elementele cele mai periculoase și foarte toxice, care are capacitatea de a se acumula în plante și animale și corpul uman, adică, este efectul cumulativ al otrăvii.
Toxicitatea mercurului depinde de tipul compușilor săi, care sunt absorbiți, metabolizați și îndepărtați în mod diferit din organism. Compușii cei mai toxici de lanțuri scurte de alchilmercur sunt metilmercur, etilmercur, dimetilmercur. Mecanismul efectelor toxice ale mercurului este asociat cu interacțiunea sa cu grupările sulfhidril ale proteinelor. Prin blocarea lor, mercurul modifică proprietățile sau inactivează o serie de enzime vitale. Compușii anorganici ai mercurului perturbe schimbul de acid ascorbic, piridoxină, calciu, cupru, zinc, seleniu; organice - schimbul de proteine, cisteina, acidul ascorbic, tocoferolii, fierul, cuprul, manganul, seleniul.
Efectul de protecție atunci când este expus la mercur pe corpul uman este zincul și, în special, seleniul. Se sugerează că acțiunea protectoare a seleniului se datorează demetilacei mercurului și formării unui compus netoxic, complexul de seleniu-mercur.
O mare toxicitate la mercur este indicată de valori foarte scăzute ale MPC: 0,0003 mg / m3 în aer și 0,0005 mg / l în apă. Un nivel sigur de mercur din sânge este considerat a fi de 50-100 μg / l. O persoană primește aproximativ 0,05 mg de mercur cu o dietă zilnică, care este în conformitate cu recomandările FAO / OMS.
Plumbul este unul dintre cele mai frecvente și mai periculoase substanțe toxice. Istoria aplicării sale este foarte veche, datorată simplității relative a producției sale și prevalenței ridicate în crusta pământului (1,6x10-3%). Compuși de plumb - Pb3O4 și PbSO4 - baza pigmenților pe scară largă: surrey și white lead. Glazurile, care sunt utilizate pentru acoperirea vesela ceramică, conțin, de asemenea, compuși Pb.
Conducta metalică din epoca Romei antice este folosită pentru a monta conducte de apă. În prezent, lista de domenii de aplicare este foarte larg: producția de baterii, cabluri electrice, inginerie chimica, industria nucleara, emailuri, ciment, acoperiri, cristal, produse pirotehnice, chibrituri, plastic, etc ...
Producția mondială de plumb este mai mare de 3,5x10 6 tone pe an. Ca rezultat al activității industriale în apa naturală de 500-600 mii. Tone de accesări în fiecare an, iar atmosfera prelucrată și fin divizată aruncat la aproximativ 450 mii. Tone, marea majoritate, care este depus pe suprafața pământului. Principala sursă de poluare a aerului cu plumbul este gazele de eșapament ale vehiculelor (260 mii tone) și arderea cărbunelui (aproximativ 30 mii tone).
Mecanismul efectelor toxice ale plumbului are o directivitate dublă. În primul rând, bloc-SH funcționale grupe de proteine și, în consecință - inactivarea enzimelor și în al doilea rând, plumb de penetrare în celulele nervoase și musculare, formarea de lactat de plumb, fosfat de plumb, apoi, care creează o barieră pentru penetrarea celulară a ionilor de Ca2 +. Principalele obiective pentru expunerea la plumb sunt sistemele hematopoietice, nervoase și digestive, precum și rinichii.
Intoxicarea cu plumb poate duce la probleme grave de sănătate, manifestată prin dureri de cap frecvente, amețeli, oboseală crescută, iritabilitate, agravarea somnului, hipotensiune musculară. iar în cele mai severe cazuri la paralizie și pareză, retard mintal. Nutriția necorespunzătoare, o deficiență în dieta de calciu, fosfor, fier, pectine, proteine (sau creșterea consumului de calciferol) crește absorbția plumbului și, prin urmare, toxicitatea acestuia. Valoarea zilnică admisă (DSD) de plumb este de 0,007 mg / kg; concentrația maximă admisă în apa potabilă este de 0,05 mg / l.
Măsurile de prevenire a contaminării cu plumb a materiilor prime și a produselor alimentare ar trebui să includă controlul de stat și departamental al emisiilor industriale de plumb în atmosferă, corpuri de apă și sol. Este necesar să se reducă sau să se elimine în mod semnificativ utilizarea de tetraetil plumb în benzină, stabilizatori de plumb, produse din PVC, coloranți, materiale de ambalare etc.
Cadmiul este utilizat pe scară largă în diverse industrii. În aer, cadmiul vine împreună cu plumbul atunci când combustibilul este ars la centrala de cogenerare, emisiile de gaze provenind de la întreprinderile care produc sau utilizează cadmiu. Contaminarea tasări solului se produce atunci când aerosolii cadmiu cadmiu din aer și a îngrășămintelor minerale suplimentate: superfosfat (7,2 mg / kg), fosfat de potasiu (4,7 mg / kg) nitrat (0,7 mg / kg).
O țigară conține 1,5-2,0 μg Cd. Ca și mercurul și plumbul, cadmiul nu este un metal vital. Intrând în organism, cadmiul prezintă un efect toxic puternic, principalul țintă fiind rinichii. Mecanismul efectelor toxice ale cadmiului este asociat cu blocarea grupelor sulfhidril de proteine; În plus, este un antagonist de zinc, cobalt, seleniu, inhibă activitatea enzimelor care conțin aceste metale. Capacitatea cadmiului de a rupe schimbul de fier și calciu este cunoscută.
Toate acestea pot duce la o gamă largă de boli: hipertensiune arterială, anemie, boală coronariană, insuficiență renală și altele. Au fost observate efecte carcinogene, mutagene și teratogene ale cadmiului. Conform recomandărilor OMS, doza zilnică permisă (cDD) de cadmiu este de 1 μg / kg greutate corporală.
Aluminiu. Primele date privind toxicitatea aluminiului au fost obținute în anii '70. XX secol. și aceasta a fost o surpriză pentru umanitate. Fiind cel de-al treilea element cel mai comun al crustății pământului (8,8% din masa crustă a pământului este A1) și posedând calități valoroase, metalul de aluminiu a găsit o largă aplicație în inginerie și în viața de zi cu zi. Furnizorii de aluminiu din corpul uman sunt vase din aluminiu dacă intră în contact cu un mediu acid sau alcalin, apă îmbogățită cu ioni A1 3+ atunci când este tratată cu sulfat de aluminiu la stațiile de tratare a apei.
Un rol important în poluarea mediului cu ionii A1 3 + este jucat și de ploile acide. Nu abuzați medicamentele care conțin hidroxid de aluminiu: aciditate hemoroidală, anti-artrită, gastrică. Hidroxidul de aluminiu și unele preparate de aspirină și ruj se adaugă ca aditiv tampon. Printre alimente, ceaiul are cea mai mare concentrație de aluminiu (până la 20 mg / g).
ioni ingerată A1 3+ sub formă de fosfat insolubil excretat în fecale, sunt absorbite parțial în sânge și excretat prin rinichi. Dacă se produce acumularea activității renale aluminiu, ceea ce duce la perturbarea metabolismului Ca, Mg, P, F, însoțită de o creștere a fragilității osoase, dezvoltarea diferitelor forme de anemie. Mai mult, au fost descoperite și toxicitate manifestări mai formidabile aluminiu: .. Perturbarea vorbire, probleme de memorie, dezorientare, etc. Toate acestea permit de a aduce „inofensive“, considerate non-toxice, până de curând de aluminiu la un „sumbre trei“ supertoxicants: Hg, Pb , Cd.
Arsenicul ca element în forma sa pură este toxic numai în concentrații ridicate. Ea aparține urmelor de elemente, necesitatea care nu a fost dovedită și compușii săi, cum ar fi anhidrida arsenios, arsenites și arsenați, puternic toxice pentru organismul uman. Arsenicul se găsește în toate obiectele din biosferă (2 mg / kg în scoarța pământului, 5 μg / kg în apa de mare). Sursele cunoscute de poluare a mediului sunt centralele de arsenic care folosesc cărbune brun, topitorii de cupru; se utilizează în producția de semiconductori, sticlă, coloranți, insecticide, fungicide etc.
În funcție de doză, arsenic poate provoca intoxicații acute și cronice, o singură doză de 30 mg arsenic - este letală pentru oameni. Mecanismul efectelor toxice ale arsenului este asociat cu blocarea grupurilor SH de proteine și enzime care efectuează o varietate de funcții în organism.
Articole similare
-
Informații succinte din istoria dezvoltării mecanicii - stadopedia
-
Principalele tipuri și forme de interacțiuni sociale - stadopedia
Trimiteți-le prietenilor: