• Reprezentanții familiei de miozine efectuează hidroliza ATP în conformitate cu schema generală
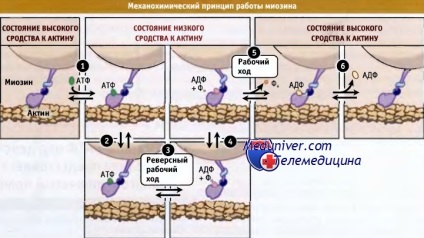
• Afinitatea miozinei pentru actină este determinată de nucleotidul (ATP, ADP-FN sau ADP) asociat cu situsul de legare
• Myozinele care conțin ATP sau ADP-FN în situsul de legare sunt doar slab capabile să se lege de actin
• În starea de miozina de cuplare în vrac asociază rapid cu actina și rapid desprins din ea
• Hidroliza ATP "activează" miozina și apare până când aceasta din urmă este asociată cu actina
• Ca rezultat al cursei de lucru a miozinei, se generează un efort și se eliberează fosfat după re-legarea actinei cu myosin-ADP-Fn
• Myozinele care conțin ADP în situsul de legare sau nu conțin o nucleotidă sunt capabile de legare puternică a actinei
• Într-o stare de legare puternică, miozinele rămân atașate de actină de mult timp
• Într-o stare slabă de legare, miozinele nu sunt capabile să genereze stres
• În stare de legare puternică, miozinele nu se mișcă atunci când se aplică forțe externe
Toate miozinele cunoscute efectuează hidroliza ATP la ADP și FN în conformitate cu schema generală. Schema de mai jos prezintă schema de hidroliză ATP. cuplată cu rotația brațului pârghiei. Această conjugare a hidrolizei ATP cu modificări conformaționale permite miozinei să avanseze ea însăși și să promoveze cargoul de-a lungul filamentelor actinice.
În absența ATP, miozina se leagă stereospecific la actin, formând așa-numitul. rigor mortis. (După moarte, nivelul ATP scade, iar mușchii își pierd elasticitatea, ceea ce se datorează formării unui complex actomiozin, ceea ce duce la rigiditatea morticii.)
Atunci când ATP este legat de miozină (pasul I din figură), deschiderea care leagă actina este deschisă; interacțiunea actinei cu miozina este slăbită. Aceasta conduce la separarea miozinei de actină (etapa 2). Cu o astfel de miozină conformație ferm se leaga ATP ea hidrolizează nu este necesar pentru cataliză catene laterale de aminoacizi chimice aranjate astfel încât acestea nu pot ataca legătura b-fosfat din ATP.
Miozină doua schimbare conformațională se produce, având ca rezultat hidroliza ATP la ADP și Pi, restul asociat ne-covalent cu miozina (etapa 3). Această modificare conformațională implică mișcarea elementelor structurale din domeniul motor care conduc la rotirea domeniului reglementar. Domeniul de reglementare care acționează ca brațul pârghiei de miozină se rotește până la starea inițială, în care miozina este gata să efectueze un accident vascular cerebral de lucru.
Fără legat actin eliberare fosfat de miozină în starea inițială este extrem de lent. Acest lucru face posibil să nu să-și petreacă myosin ATP atunci când nu interacționează cu actina. După legarea la actină (etapa 4) rata de fosfat eliberare miozinei crește puternic.
Forța de forță a miozinei. de exemplu, rotația domeniului de reglementare (etapa 5), însoțește etapa de eliberare a fosfatului. După finalizarea forței de putere este eliberată ADP (etapa 6), având ca rezultat formarea de myosin, Actin atașată, dar care nu conține nucleotidelor. Ciclul se repetă când ATP se adaugă la miozină. In zavisimolsti tipul miozinei fiecare buclă de legare a ATP și hidroliza acestuia duce la eliberarea de promovare a fosfatului filamente de actină la o distanță cuprinsă între 3 și 23 nm.
Afinitatea miozinei pentru actină în timpul ciclului de hidroliză ATP variază. Produsele intermediare ale acestui ciclu pot fi caracterizate în funcție de afinitatea lor pentru filamentele actinice. Myosins care conțin ATP sau ADP-FP sunt legate într-o stare de cuplare vrac sau generarea eforturilor preliminare (etapele 2 și 4), caracterizat prin montarea și disocierea filament Actin în cronologie de 100 de ori mai rapid decât ciclul de hidroliză ATP.
Aceste stări slabe de legare nu dau forță. În cazul în care filamentul de actină este desenată cu privire la myosin în aceste state, Myosins sa alunece pe filamentele în care acestea sunt atașate și detașate de la actinei foarte repede. Într-o stare slab legată, miozina se rotește în starea inițială, pregătindu-se pentru generarea de eforturi. Dacă filamentele actinice sunt alungite, miozina este puternic asociată cu aceasta și rezistă mișcării și acționează ca o ancoră cu filament actin.
permite miozinei să facă un pas de-a lungul filamentelor actinice.
Modificările de modificări asociate ciclului ATP conduc la astfel de modificări ale afinității miozinei pentru actină,
care provoacă legarea sa alternantă cu filamentele de actină și scindarea de la acestea.
Articole similare
-
Și ce ți-au dat la lucru atunci când ai plecat pentru decretul pda - micone 2018-2018
-
Instrucțiuni pentru protecția muncii când lucrați pe o mașină cu role
Trimiteți-le prietenilor: