Cele mai multe reacții chimice nu au loc până la sfârșit. Reacțiile care pot apărea simultan în două direcții opuse se numesc reversibile. Dacă ratele de astfel de reacții devin egale,
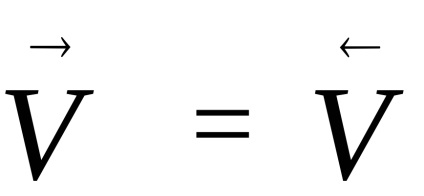
Starea de echilibru caracterizează limita la care, în condiții date, reacția care a început, se desfășoară spontan (ΔG <0). Если в системе наступило химическое равновесие, то дальнейшее изменение изобарно-изотермического потенциала происходить не будет (см. рис.1)
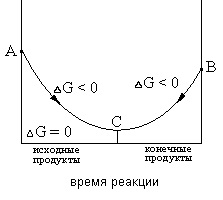
Figura 1 Schimbarea ΔG în timp ce reacția se desfășoară

Pentru o reacție reversibilă omogenă aA + bB

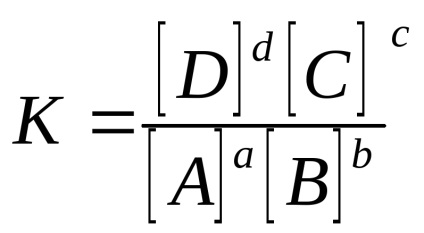
în cazul sistemelor de gaz:
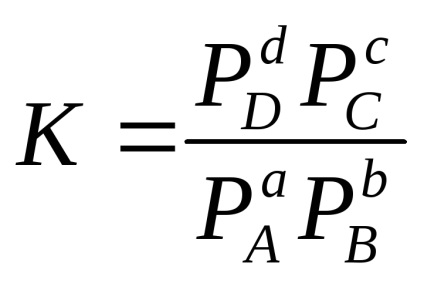
De exemplu, pentru reacție:
O caracteristică a echilibrului chimic eterogen este absența constantelor de echilibru ale termenilor referitori la substanțele solide.
La o temperatură dată, presiunile parțiale ale reactivilor în starea condensată (solidă și lichidă) sunt constante și nu depind de cantitatea de reactivi. Prin urmare, aceste presiuni parțiale sunt de obicei incluse în constanta de echilibru. Astfel, pentru reacție
CaCO3 (t) = CaO (t) + CO2 (r);
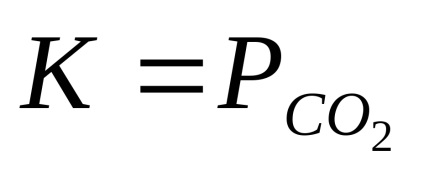
Constanta de echilibru este asociată cu o modificare a potențialului izobaric-izotermic al reacției chimice ΔG ° prin relația:
Deoarece ΔG ° = ΔНº - TΔS °; RlnK = ΔS ° - ΔNº / T
Prin urmare, K = e-Δ H º / RTe ΔS º / R
În condiții de echilibru a reacției reversibile ΔG ° = ΔH ° - T · ΔS ° = 0, este posibil să se calculeze temperatura la care echilibrul se fixează în
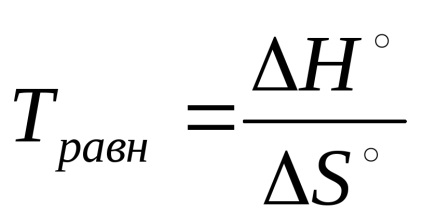
Din aceste ecuații rezultă că constanta de echilibru este foarte sensibilă la o schimbare a temperaturii. Influența asupra constantei de echilibru a naturii substanțelor care reacționează determină dependența de factorii entalpi (ΔH) și entropia (ΔS °).
Constanta de echilibru nu depinde de concentrația reactivilor și de presiune (dacă nu este foarte mare). Când condițiile (temperatura, presiunea, concentrația) se modifică, starea de echilibru este încălcată.
Reechilibrare, în funcție de condițiile de schimbare, în general, de principiu, Le Chatelier lui: Dacă sistemul este în echilibru, au un impact din exterior prin schimbarea oricare dintre condițiile care determină echilibrul, acesta este deplasat în direcția fluxului de proces care slăbește efectul a acțiunii. În consecință, creșterea temperaturii schimbă echilibrul către procesul endotermic și scăderea - către procesul exotermic. Având în vedere că ΔH = -Q
RlnK = ΔS ° + Q / T (pentru o reacție exotermă).
RlnK = ΔS ° - Q / T (pentru reacția endotermică).
În general, reacțiile endotermice sunt caracteristice regiunilor cu temperatură ridicată și reacțiile exoterme în regiunile cu temperatură scăzută. Creșterea presiunii schimbă echilibrul către formarea unui număr mai mic de molecule gazoase, o creștere a concentrației substanțelor inițiale, către formarea de produse de reacție. Cu efectul opus, echilibrul se va schimba, respectiv, către formarea substanțelor inițiale. De exemplu, pentru o reacție exotermă
.
pentru echilibrul spre formarea de amoniac este necesară pentru a crește concentrația de deplasare a materiilor prime (cu cea mai avantajoasă pentru a crește concentrația de hidrogen), pentru a reduce concentrația de amoniac pentru a reduce temperatura sau crește presiunea.
Adsorbția este procesul de absorbție a unei substanțe de suprafața alteia datorită câmpurilor de forță necompensate ale particulelor din stratul de suprafață (pe interfața fazelor).
Substanțele ale căror particule sunt absorbite (gaz, lichid, component dizolvat) se numesc adsorbate, iar absorbantul este adsorbant.
Interacțiunile dintre particulele adsorbate și cele adsorbante pot avea un caracter diferit. În funcție de natura acestei interacțiuni, se disting adsorbția fizică și chimică (chemisorbția).
Cu adsorbția fizică, particulele adsorbate și adsorbante sunt legate de forțele de interacțiune intermoleculară relativ slabe (forțele van der Waals). Un exemplu de adsorbție fizică este adsorbția gazelor sau a substanțelor dizolvate de cărbune activ.
În timpul chimisorbției, particulele adsorbate și adsorbante sunt legate de forțe de aderență mai puternice datorită interacțiunii chimice rezultate care conduce la formarea unei noi substanțe. Un exemplu de chemisorbție este adsorbția oxigenului prin metale. Procesul de detașare a particulelor adsorbate de pe suprafața adsorbantului, adică fenomenul, inversul adsorbției, se numește desorbție. Dacă în sistemul adsorbant-adsorbant, în condiții date, viteza de adsorbție este egală cu rata de desorbție, starea sistemului se numește echilibrul de adsorbție. Chemisorbția continuă ireversibil.
Cantitativ adsorbție de adsorbat, exprimată în moli per unitate adsorbant suprafață (mol / m 2) sau de adsorbat în moli per unitate de greutate de absorbant (mol / g).
Valoarea adsorbției depinde de natura adsorbantului și adsorbatului, temperatura și concentrația (sau presiunea) adsorbatului. Curba valoare de adsorbție a concentrațiilor de echilibru ale adsorbantului sau presiunea p la temperatură constantă T se numește izotermei de adsorbție: T = f (c) sau F = f (p) la T = const.
Dependența adsorbției de concentrația adsorbantului (T = const) este exprimată prin ecuația Langmuir (cu condiția ca suprafața adsorbantului să fie omogenă).
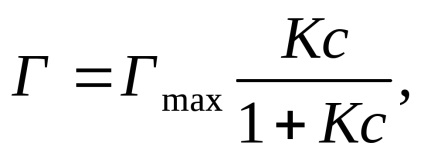
unde Γ este valoarea adsorbției; Hmax este valoarea maximă a adsorbției datorată suprafeței adsorbantului; K este constanta de echilibru a adsorbției; c este concentrația de echilibru a adsorbantului.
Adsorbția crește odată cu creșterea concentrației sau presiunii substanțelor adsorbite în funcție de izotermia de adsorbție (figura 2, a).
Exprimând ecuația lui Langmuir sub forma:
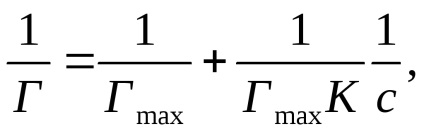
se obține o dependență liniară de 1 / T la 1 / c (figura 2b).
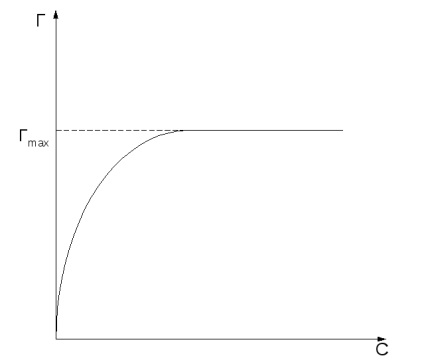
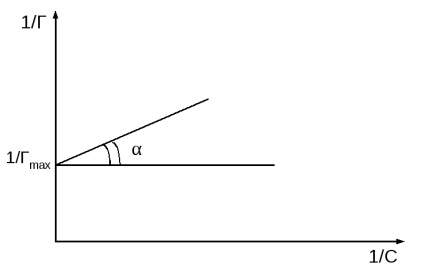
Fig.2 Izotermul Langmuir în două forme.
Pe axa de ordonare, un segment egal cu 1 / Gmax este tăiat. și tgα = 1 / K · Gmax
Graficul construit în coordonatele 1 / r - 1 / s, absorbția calculată valoarea maximă (Gmax), o atunci ecuația Langmuir echilibrul de adsorbție constantă (K).
La valori ridicate ale concentrațiilor (presiunilor), cantitatea K · s »1
(K · p »1), ecuația Langmuir ia forma Γ = Γmax.
Adsorbția este utilizată pe scară largă în flota marină, de exemplu, atunci când se curăță gazele și lichidele din diferite impurități; la procesarea apei de proces marin și la îmbunătățirea performanțelor lubrifianților, la rezolvarea problemelor de mediu din flotă etc.
Articole similare
Trimiteți-le prietenilor: