Principalii factori care afectează concentrația critică a formării micelilor. Metode pentru determinarea CMR
concentrație critică a miceliilor - cea mai importantă caracteristică a soluțiilor de surfactanți. Ea depinde în primul rând de structura radicalilor de hidrocarburi din molecula de surfactant și gruparea tera polar caracterizat, prezența în soluția de electroliți și non-electroliți, temperatură și alți factori.
Lungimea radicalului de hidrocarbură are o influență decisivă asupra procesului de formare a micelilor în mediu apos. Scăderea energiei Gibbs a sistemului ca rezultat al formării micelilor este cu atât mai mare, cu atât lanțul de hidrocarburi este mai lung. Studiile arată că formarea asociaților premicelari este observată în electroliții activi de suprafață cu prezența a mai mult de patru atomi de carbon în lanțul de hidrocarburi. Cu toate acestea, la astfel de compuși, diferența dintre părțile hidrofile și hidrofobe (valoare ridicată a HLB) este slab exprimată. În acest sens, energia de asociere este insuficientă pentru a menține moleculele dintr-o mișcare termică aleatorie și, prin urmare, să creeze condiții pentru micelizare. În mod caracteristic, capacitatea de micelă este inerentă în molecule de surfactant cu o lungime a radicalului hidrocarbonat mai mare de 8-10 atomi de carbon.
Ecuația de stabilire a relației dintre lungimea CMC a radicalului hidrocarbonat poate fi dedusă din considerația formării micelilor ca proces de formare a unei noi faze. La echilibru, potențialul chimic al agenților tensioactivi în soluția qp și în micelă este egal cu qp = \ q, m și putem scrie:
Presupunând că micela este o fază de surfactant pur, putem presupune că activitatea din micelă este egală cu unitatea. Atunci primim:
Partea stângă a ecuației (VI.52) este energia transferului materiei din soluție în stare pură, adică energia de dizolvare. Se știe că energia de dizolvare a compușilor organici în apă scade liniar cu creșterea lungimii radicalului de hidrocarbură. prin urmare
RnKRM = a - bn (VI.53)
Unde a este o constantă care caracterizează energia de dizolvare a grupurilor funcționale (părți polare ale moleculelor); B este o constantă care caracterizează energia de dizolvare pe o grupă CH2; n este numărul de grupări CH2.
Pentru un mediu organic avem:
RT În K. KM = a + 6rt (VI.54)
Adică, pe măsură ce lungimea radicalului de hidrocarbură crește, solubilitatea surfactantului crește și CMC crește. Ramificarea, nesaturarea și ciclizarea radicalului hidrocarbonat reduc tendința de formare a micelilor și măresc CMC.
Natura grupului polar joacă un rol important în formarea micelilor în medii apoase și neapoase. Influența sa asupra CMC reflectă parametrul a în ecuațiile (VI.53) și (VI.54). Rolul grupurilor hidrofile în soluțiile apoase de agenți tensioactivi este de a reține asociații formați în apă și de a regla dimensiunea lor. Forma sferică a micelilor ionice este stabilită dacă energia de asociere a lanțurilor de hidrocarburi este suficient de mare și depășește energia de repulsie electrostatică între grupurile ionice. Hidratarea contraionilor care înconjoară micelul promovează repulsia, în timp ce ionii mai puțin hidratați sunt mai ușor adsorbiți pe suprafața micelilor. În legătură cu aceasta, o scădere a CMC și o creștere a masei miceliare pentru surfactanții cationici în grupa C1-<В-<1- и анионных ПАВ в ряду Na+ Introducerea electroliti in soluții apoase de agent tensioactiv neionic are un efect redus asupra CMC și mărimea micelelor. Pentru surfactanții ionici, acest efect este semnificativ. Compararea proprietăților ionici și neionici, având același lanț de hidrocarbură, arată că micelare ionici în masă în multe mai puțin decât neionic și cu creșterea concentrației electrolitului tensioactivi radio-ionic crește masa micelare și surfactant neionic variază puțin. Efectul electroliților CMC este descris prin ecuația generală (ionic: surfactant): În cazul în care o "la Y" sunt constante având același înțeles fizic ca în ecuația (VI.53); K este o constantă; c este concentrația electrolitului indiferent. În absența unui electrolit indiferent, c = CMC și ecuația (VI.55) devine (VI.53); la n = const, dependența CMC se obține doar pe concentrația de electroliți. Introducerea non-electroliți (solvent organic), în soluțiile apoase de surfactant, de asemenea, are ca rezultat o schimbare în CMC. În prezența rezistența crește micelei solubilizare, adică. E. Scăderea CMC. În cazul în care moleculele de solvent nu intră în interiorul miceliilor, ele tind să crească CMC sau prin creșterea solvabilității mediului sau poate conduce la re-reducerea constanta sa dielectrică și Uwe-lichenie forțe repulsive între ionii de agent tensioactiv organic ionic. În același timp cu scăderea permitivitatea dielectrică solvent XYZ redus de disociere surfactant ion-gena care creste capacitatea agentului tensioactiv pentru a forma micelii. Pentru a controla proprietățile amestecurilor de agent tensioactiv sunt utilizate în care apar efecte sinergice sau antagonice, t „e astfel de amestecuri pot avea formând o micelă substanțial mai mare sau mai puțin mare, solubilizat - .. capacitatea Ruyuschuyu et al. Metode de determinare a LSP bazate pe detectarea schimbării bruscă a proprietăților fizico-chimice ale soluțiilor de agent tensioactiv depind-ing de concentrația (de exemplu, o tensiune superficială-TION și turbiditate t, echivalentă conductivitate K, I, indicator prelomleniyap-osmo matic presiune). Curba proprietății - structură în CCM care apare de obicei fractură etsya (Figura VI.6.). Una dintre ramificațiile curbelor (la concentrații mai mici) din Fig. VI.6 descrie proprietățile sistemului într-un co-picioare moleculare, iar celălalt - în coloidului. Abscisa condițional breakpoint numărarea-out corespunzătoare tranziției moleculelor în micelii, t. E. Concentrația critică
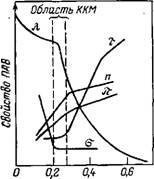
Fig. VI.6. Dependenta de turbiditate t, echivalentă conductivitate-valență X, suprafață tensiune a unei, indicele de refracție n I a presiunii osmotice a dodecil soluție - sulfat de sodiu în apă, de la koitsentra ei - (. Wt) C,% TION
Trimiteți-le prietenilor: