Boila este o tranziție de fază în care un lichid este transformat în vapori, cu formarea bulelor de vapori în întregul volum al lichidului.
Punctul de fierbere al unui lichid este temperatura la care presiunea vaporilor saturați pe un lichid dat este egală cu presiunea externă. La această temperatură și presiunea de vapori saturată corespunzătoare, se stabilește un echilibru între fazele lichide și cele gazoase (rata de evaporare este egală cu rata de condensare) și ambele faze pot coexista mult timp. Dacă lichidul este o substanță individuală și presiunea externă nu se schimbă, atunci fierberea într-un vas deschis are loc la o temperatură constantă până când faza lichidă dispare complet. Temperatura la care acest lichid se fierbe la o presiune de 101325 Pa este numit punctul de fierbere normal.
Înghețarea (solidificarea) este o tranziție de fază în care un lichid este transformat într-un solid al cărui particule (cristale) sunt formate pe întregul volum al lichidului.
Punct de congelare (cristalizare) lichid se numește temperatura la care presiunea de vapori a lichidului este egală cu presiunea vaporilor saturați peste scăderea a cristalelor în fază solidă. La această temperatură și echilibrul saturat corespunzător presiunii vaporilor între fazele lichide și solide (rata de cristalizare este rata de topire) și ambele faze pot coexista pentru o lungă perioadă de timp. Dacă lichidul este o substanță individuală și presiunea externă rămâne constantă, atunci când este răcită, temperatura rămâne constantă, corespunzătoare temperaturii de congelare, până când are loc solidificarea completă.
Pentru a schimba echilibrul spre cristalizare, temperatura ar trebui să fie redusă, deoarece cristalizarea este un proces exotermic. Dacă dizolvați o anumită substanță în lichid, concentrația acestuia va scădea și în sistemul de fază lichid-fază procesul de topire se va intensifica. Aceasta implică dependența (Legea lui Raoul II):
Creșterea punctului de fierbere, precum și scăderea temperaturii de cristalizare a soluțiilor diluate este direct proporțională cu molitatea soluției și nu depinde de natura substanței.
unde: uK - constantele ebullioscopice și crioscopice (depind de natura solventului, nu depind de natura substanței și de concentrația acesteia)
Proprietățile și mecanismele de formare a soluțiilor lichide sunt diverse, așadar crearea unei teorii unificate a soluțiilor este asociată cu dificultăți considerabile. Există mai multe puncte de vedere asupra naturii soluțiilor: fizice, chimice și complexe.
Mecanismul dizolvării în cadrul modelului complex poate fi reprezentat în trei etape: 1) orientarea moleculelor de solvenți polari în jurul particulelor dizolvate, formarea legăturilor ion-dipol; 2) ruperea legăturilor într-o substanță dizolvată; 3) solvarea ionilor în soluție.
Primele două etape sunt asociate cu cheltuielile de energie, iar a treia cu alocarea sa. Raportul dintre energii determină căldura de dizolvare și, astfel, exotermicitatea sau endotermicitatea procesului de dizolvare.
Este cunoscut faptul că, în structura sa a unui lichid într-o poziție intermediară între gazele în care moleculele sunt aranjate aleator, și cristalele, în care particulele sunt la anumite distanțe față de cealaltă în rețeaua cristalină. În lichide, unele elemente ale structurii comandate sunt reținute. De exemplu, se crede că apa păstrează parțial structura gheții, în care fiecare moleculă are legături de hidrogen cu patru molecule învecinate.
Când se formează o soluție datorită apariției unor noi forțe de interacțiune între particule, structura lichidelor pure este întreruptă. Există o nouă structură cu un aranjament diferit de particule și o interacțiune diferită între ele. Toate acestea afectează foarte mult procesele care apar în soluții.
Proprietățile soluției depind în mare măsură de compoziția sa. Prin urmare, cele mai importante caracteristici ale soluției sunt concentrațiile componentelor sale. Modalitățile de exprimare a concentrațiilor sunt diferite. Cel mai adesea folosit:
1. Fracția molară este raportul dintre cantitatea de compus i-component ni. conținută în soluție, la cantitatea totală de substanță din sistemul n 1.
2. Fracția totală este raportul volumului ocupat de componenta i a lui Vi. la volumul total al sistemului V.
3. Fracțiunea masică - raportul masic al componentei i (mi) la masa totală a sistemului m.
4. Concentrația molară este raportul dintre cantitatea de i-component ni. la volumul ocupat de sistemul V.
Concentrația molară este exprimată în mol / m 3 mol / l. Denumirea M.
5. Concentrația molară sau molitatea este raportul dintre cantitatea de i-component ni. la masa de solvent mp.
Concentrația molară este exprimată în mol / kg. De exemplu, termenul "soluție monomoleculară" înseamnă o soluție care conține 1 mol de substanță dizolvată în 1 kg de solvent.
6. Concentrația molară a echivalentului este raportul dintre numărul de echivalenți i ai substanței și volumul ocupat de sistem.
Concentrația molară a echivalentului este exprimată în mol / m 3 mol / l. Denumirea n.
Când solutul este introdus în solvent, procesul de dizolvare are loc spontan pentru un timp, adică soluția rămâne nesaturată, ceea ce înseamnă că o anumită cantitate de substanță poate trece în soluție. Când soluția devine saturată, atunci într-un astfel de sistem, soluția și excesul de substanță dizolvată pot coexista pe o perioadă lungă de timp, fără modificări. Starea de echilibru poate fi încălcată doar ca urmare a modificărilor de temperatură, presiune sau introducerea altor substanțe. Soluția suprasaturată concentrației substanței este mai mare decât în saturate (la o anumită temperatură și presiune), se poate prepara încet și cu grijă răcire temperatura saturată în soluție ridicată de sare a unui acid slab (tiosulfaților și acetați de metale alcaline). Soluția suprasaturată este un sistem care se află într-un echilibru aparent. Agitarea sau introducerea în el a cristalelor aceleiași substanțe care sunt în soluție cauzează cristalizarea, excesul de substanță dizolvată este eliberat și soluția devine saturată.
Solubilitatea acestei substanțe este egală cu concentrația sa în soluția saturată. Pentru diferite substanțe, variază considerabil. Substanțe absolut insolubile acolo. Solubilitatea depinde de natura substanței, de starea ei agregată și de condițiile externe (temperatură, presiune, etc.). Odată cu dizolvarea unor substanțe, are loc o contracție - comprimarea volumului sistemului: volumul soluției se dovedește a fi oarecum mai mic decât suma volumelor substanței dizolvate și a solventului. Astfel, atunci când se amestecă 48 de volume de apă cu 52 volume de alcool etilic la o temperatură de 293 K în loc de 100 volume de amestec, se obține doar 96,3. Acest lucru se datorează interacțiunii alcoolului și a apei cu formarea hidraților, precum și compactarea reciprocă a moleculelor lor în spațiu.
Gazele sunt capabile să se dizolve în lichide, dar nu nelimitat, dar până la o anumită limită corespunzătoare formării unei soluții saturate. După atingerea stării de saturație, se stabilește un echilibru dinamic între soluție și gazul de deasupra. Acest echilibru se caracterizează prin faptul că, pe unitatea de timp, numărul moleculelor de gaz care intră în lichid prin suprafața sa este egal cu numărul de molecule de gaze care ies din lichid.
Dizolvarea gazelor este aproape întotdeauna însoțită de eliberarea căldurii (datorită solvației moleculelor lor). Conform principiului Le Chatelier, solubilitatea gazelor scade odată cu creșterea temperaturii și crește cu răcire.
Legea lui Henry (1803) exprimă dependența de solubilitatea gazelor la presiune: solubilitatea unui gaz dat într-un lichid este proporțională cu presiunea asupra lichidului: C = Kp,
unde c este concentrația de gaz din lichid, k este coeficientul de proporționalitate, care depinde de natura gazului, p este presiunea gazului asupra soluției.
Volumul gazului dizolvat nu depinde de presiunea externă, deoarece, atunci când presiunea este mărită, concentrațiile de gaz dizolvat și de gaze deasupra soluției cresc de un număr egal de ori. Astfel, solubilitatea gazului într-un lichid este proporțională cu presiunea parțială.
Presiunea parțială a azotului este de aproximativ 4 ori mai mare decât presiunea parțială a oxigenului. Prin urmare, pe măsură ce crește presiunea, soluția este îmbogățită cu azot.
Astfel de soluții sunt ideale, formarea de componente care, luate într-o stare similară de agregare și în orice raport, nu este însoțită de modificări de volum și efect termic, iar schimbarea entropiei este egală cu variația de entropie în timpul amestecării gazelor ideale:
Legea lui Dalton: Când se dizolvă un amestec de gaze în lichid, fiecare gaz se dizolvă în proporție directă cu presiunea parțială.
În funcție de natura fluidelor care alcătuiesc sistemul, distingeți:
sisteme constând din lichide miscibile nelimitate (apă și alcool etilic, apă și esență acetică)
sisteme care constau în lichide care se leagă să se dizolve unul în celălalt (apă și anilină, apă și eter)
sisteme de practic insolubil în fiecare alte lichide (apă și benzină, apă și mercur).
Temperatura la care solubilitatea limitată devine nerestricționată se numește temperatura critică de dizolvare.
Solubilitatea reciprocă a componentelor poate fi mărită sau scăzută prin introducerea unei a treia componente.
De exemplu, anilina poate fi amestecată nelimitat cu apă la toate temperaturile dacă există suficientă iodură de litiu (deoarece această sare se dizolvă la fel de bine în ambele lichide). Uneori, introducerea celei de-a treia componente permite transformarea soluției omogene într-o soluție în două faze. De exemplu, pentru a extrage alcoolul etilic din soluția apoasă, este suficient să se adauge catașul cristalin și să se agită viguros. După uscare, soluția este împărțită în două straturi nemiscibile.
De regulă, sunt luate în considerare soluțiile de solide în lichide. Proprietățile soluțiilor respectă cele trei legi formulate de Raul, iar al patrulea - Vant Hoff.
Proprietățile soluțiilor diluate de substanțe care nu depind de natură, dar depinzând numai de concentrația lor, se numesc colligative. Acestea includ presiunea osmotică, o scădere a presiunii saturate a vaporilor deasupra soluției, o scădere a temperaturii de cristalizare și o creștere a punctului de fierbere al soluției.
Conform legii lui Raoult, presiunea saturată a vaporilor peste soluția diluată este mai mică decât cea a solventului pur.
Un rol important în organismul plantelor și animalelor îl are fenomenul de osmoză. Osmoza este procesul de difuzie unică a unui solvent printr-o membrană semipermeabilă dintr-o soluție cu o concentrație mai mică la o soluție cu o concentrație mai mare.
În soluțiile diluate, osmoza nu depinde în mod explicit de tipul de substanță dizolvată și solvent. Valoarea decisivă este concentrația soluției. Materialele prin care trece solventul și care nu trec printr-o substanță dizolvată sunt numite semipermeabile.
Ecuația lui Van't-Hoff:
Valoarea presiunii osmotice depinde de concentrația substanței dizolvate.
Tulburările de osmoză și modificările presiunii osmotice din organism duc la consecințe nedorite. Scăderea presiunii osmotice este cauzată de introducerea unei cantități mari de exces de apă în corp sau ca urmare a pierderii de săruri, de exemplu, prin transpirație. Poate provoca vărsături, convulsii și, în cazuri grave, duce la moartea corpului. Presiunea osmotică crescută este asociată cu introducerea excesului de săruri în organism și cu redistribuirea apei, ceea ce duce la acumularea de săruri în exces în țesuturi și există umflături.
Presiunea osmotică este una dintre cauzele mișcării apei la plante și creșterea acesteia de la rădăcini la vârf. Din frunzele plantelor aflate sub influența proceselor atmosferice, apa se evaporă, pierderea acesteia fiind compensată prin absorbția osmotică din celulele stem.
Soluția, spre deosebire de un solvent pur, nu îngheață la o temperatură constantă. Cristalele încep să se separeze la o singură temperatură, pe măsură ce temperatura lor scade, cantitatea lor crește până când întreaga soluție se transformă într-o fază solidă. Temperatura la care soluția începe să formeze cristale se numește punctul de congelare a soluției. la punctul de congelare, cristalele solventului sunt în echilibru cu o soluție a compoziției date.
Experiența arată că soluția diluată îngheață la o temperatură mai mică decât solventul pur. Diferența dintre temperaturile de îngheț a solventului și a soluției se numește scăderea punctului de îngheț # 916;
k este constanta crioscopica. Această valoare este numeric egală cu scăderea punctului de îngheț al unei soluții monomolar, cu condiția să rămână ideală. iar substanța dizolvată nu disociază și nu se asociază. Constanta crioscopică depinde de natura solventului și nu depinde de natura substanței dizolvate. Pentru apă, 1,86; pentru fenol - 7,27, pentru benzen - 5,10 Kg / mol. Aceasta înseamnă că, atunci când aceeași substanță este dizolvată în acești solvenți cu concentrație egală, cea mai mare scădere în punctul de congelare va fi observată în fenol, cel mai mic în apă.
Ca urmare a scăderii presiunii de vapori deasupra soluției de materie nevolatilă, punctul de fierbere al soluției crește. Prezența unei substanțe dizolvate determină o creștere a punctului de fierbere al soluției.
E este constanta ebullioscopică. Depinde numai de solvent. Pentru apă 0,51, fenol - 3,04.
Trebuie reținut faptul că punctul de fierbere al soluțiilor este mai mare decât punctul de fierbere al apei. Prin urmare, arsurile din soluțiile fierbinți sunt mai dureroase decât arsurile din solvenții fierbinți.
Curs 4 "Disocierea electrolitică în soluție apoasă"
Substanțele - electroliții sunt:
1. baze solubile - alcalii,
2. acizi,
3. Săruri solubile.
Oxizi la electroliți nu aparțin, deoarece nu se dizolvă pur și simplu în apă, ci intră într-o reacție chimică cu ea, formând un hidroxid care disociază. Adesea există substanțe în ale căror molecule se observă două tipuri de legături. De exemplu, în hidroxid de sodiu-NaOH, sodiul este legat de gruparea hidroxi printr-o legătură ionică, iar hidrogenul cu oxigen este covalent. În molecula H2SO4 a acidului sulfuric, legătura dintre hidrogen și reziduu acid este mai polară decât legătura dintre sulf și oxigen. În azotatul de aluminiu Al (NO3) 3, aluminiu este legat la restul acid printr-o legătură ionică, iar atomii de azot cu atomi de oxigen sunt covalenți. În astfel de cazuri, descompunerea moleculei în ioni are loc la locul legăturii ionice sau cea mai polară, a cărei despicare necesită mai puțină energie.
Din cele de mai sus rezultă că ionii pot fi formați nu numai din atomi individuali, ci și din grupuri de atomi. De exemplu, SO4 2-. NO3 -. OH -.
Pentru a cuantifica disocierea electrolitică, se introduce noțiunea de grad de disociere (a):
a = -----. unde n este numărul moleculelor de materie care s-au degradat în ioni;
N N este numărul de molecule ale substanței introduse în soluție.
În funcție de gradul de disociere, toți electroliții sunt împărțiți condiționat în condiții puternice (a = 1) și slabi (a<1). Степень диссоциации зависит от природы электролита, температуры и концентрации раствора.
Electroliții puternici includ: acizii minerali puternici HCI, H2SO4. HNO3. HMnO4 și alte hidroxizi ai metalelor alcaline și alcalino-pământoase și toate sărurile solubile.
Pentru electroliții slabi sunt: practic toate substanțele organice, acizi slabi H2CO3. H2S, HNO2. H2S03. H3PO4, bazele rămase și multe compuși binari H2O, oxizi etc.
La scrierea ecuațiilor de disociere electrolitică, este necesar să se țină seama de faptul că:
Disocierea acizilor polibazici și bazelor multi-acizi are loc în etape;
ecuația de disociere pentru electroliții puternici este înregistrată în prima etapă ca un proces ireversibil, iar pentru toate celelalte - ca reversibile (cu excepția hidroxizilor metalelor alcaline și alcalino-pământoase).
electroliții slabi disociază în mod reversibil în toate etapele:
Hidroxizii amfoterici sunt electroliți slabi și se disociază atât pe tipuri de bază, cât și pe tipuri de acizi:
Pentru a caracteriza electroliții slabi, se folosește o valoare numită constanta de disociere.
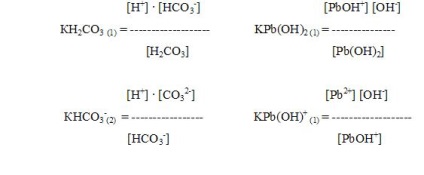
Condiția de disociere și gradul de disociere sunt în dependența matematică (legea de diluție). cu o scădere a concentrației soluției (C), gradul de disociere (a) al electroliților crește.
Din legea de diluție se pot obține formule care conectează constanta de disociere a unui electrolit slab, gradul de disociere și concentrația unui ion (Sion). Într-adevăr, din moment ce
Este ușor de observat că și Zion = un C și Zion = K / C.
Articole similare
Trimiteți-le prietenilor: