Metoda de schimbare sau de calcul a valorilor absolute ale saltului potențialului electrodului nu a fost găsită încă. Cu toate acestea, EMF-ul circuitului, format din două sau mai multe electrozi, este accesibil sumelor algebrice ale tuturor salturilor potențiale interfațiale. În cel mai simplu caz, acesta este egal cu diferența dintre cele două sărituri potențiale ale electrodului, adică este o măsură a valorilor lor relative. Mărimea fiecărui salt al potențialului de electrod poate fi considerată ca fiind punctul zero al scalei potențiale a electrodului. Acordul internațional a stabilit o scară de potențiale, conform căreia saltul în potențialul unui electrod standard de hidrogen la toate temperaturile este zero.
Electrodul standard de hidrogen constă în platină platinată în contact cu soluția, activitatea ionilor de hidrogen în care (H2SO4) și spălată printr-un curent de hidrogen gazos cu presiune de hidrogen.
Procesul de electrozi
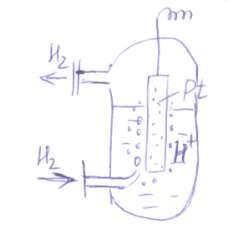
include 3 etape:
1. adsorbția hidrogenului molecular pe platină;
2. Disocierea moleculelor adsorbite pe un atom accelerat catalitic de platină;
3. Ionizarea hidrogenului atomic și trecerea lui în soluție
A treia etapă determină apariția unui salt de electrod în potențial și, prin urmare, se numește potențial de determinare a potențialului. Astfel, se stabilește un echilibru între ionii de hidrogen din soluție și hidrogenul gazos.
Electrodul de hidrogen este scris după cum urmează:
Potențialul electrodului electrodului hidrogen este scris conform ecuației Nernst:
Deoarece presiunea parțială a hidrogenului este unitatea = 1, această expresie este simplificată:
potențialul standard al electrodului hidrogen la activitatea ionilor de hidrogen = 1, în condițiile în care presiunea hidrogenului gazos este egală cu unitatea = 1 și temperatura este egală cu 289 K, este considerată zero (= 0).
Potențialul de salt al electrodului la scara convențională a electrodului de hidrogen este denumit potențialul electrodului și este notat cu. Ea este egală cu emf-ul unei celule electrochimice constând dintr-un hidrogen standard și un electrod dat. Înregistrarea unui astfel de element începe întotdeauna cu un electrod hidrogen, adică se consideră a fi lăsată.
Măsurarea electrozi a potențialului electrodului
Pentru a determina potențialul electrodului, se colectează o celulă galvanică constând dintr-un electrod al cărui potențial este de interes pentru noi și se măsoară un electrod standard de hidrogen și apoi EMF al elementului.
Un electrod standard de hidrogen a cărui potențial este presupus a fi zero și care trebuie să rămână întotdeauna relativ la celălalt electrod este scris după cum urmează:
Să determinăm potențialul electrodului de zinc. Electrodul de zinc este scris ca:
Potențialul acestui electrod este determinat de forța electromotoare a elementului.
Experiența arată că atunci când elementul funcționează, zincul este oxidat: aceasta înseamnă că un semn negativ trebuie să fie atribuit potențialului de electrod de zinc. Valoarea absolută a electrodului de zinc este:
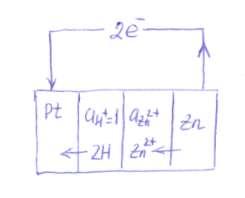
Deoarece încărcarea zincului este negativă decât încărcarea platinei, electronii se vor transfera de la zinc la platină, adică de la dreapta la stânga. În aceeași direcție - și aceasta este tipică pentru un electrod negativ care este asociat cu un electrod standard de hidrogen - cationii vor trece, de asemenea, în soluțiile corespunzătoare ale elementului.
Spre deosebire de electrodul de zinc, electrodul de cupru are un potențial pozitiv corespunzător EMF pozitiv al elementului:
Aici, în electrodul de cupru, reacția de refacere apare spontan:
Emf-ul acestui element va fi egal cu potențialul electrodului de cupru.
Cu activitatea ionilor de cupru și zinc egali cu unitatea, EMF a elementelor corespunzătoare determină potențialul standard al electrozilor de cupru și zinc.
- potențialul electrodului standard al electrodului de zinc.
Potențialele electrodului standard formează o serie care, în cazul ionilor de metal metalic în soluție apoasă, corespunde localizării metalelor prin activitatea lor chimică, adică o serie de solicitări:
Articole similare
Trimiteți-le prietenilor: