Dispozitive și procese electrochimice
Deoarece reacțiile de reducere a oxidării sunt însoțite de transferul de sarcină, ele pot fi efectuate prin acțiunea unui curent electric și invers, - pentru a obține un curent electric datorită fluxului lor. Electrozii și potențialul electrodului sunt utilizați în procesele și dispozitivele corespunzătoare.
Conceptul de potențial electrod.
Dacă placa metalică inferioară în apă sau o soluție care conține ioni de metal, atunci procesele din metal de soluție datorită metalului de dizolvare depunerea se produce o diferență sau potențial salt, care depinde de natura metalului, concentrația soluției și temperatura. Acest salt este numit potențialul electrodului unui metal dat. Acest echilibru este exprimat printr-o ecuație care ia în considerare hidratarea ionului:
în soluție pe metal
Potențialul corespunzător unui echilibru dat se numește potențialul electrodului de echilibru.
Valoarea lui j nu poate fi determinată în valoare absolută. Prin urmare, potențialul tuturor electrozilor este determinată în raport cu celula jumătate standard de hidrogen (electrod) (. Vezi Figura 7.1), care potențial este determinat să fie zero: j aproximativ 298 (2H + ® H2) = 0. Electrodul standard de hidrogen este format dintr-un vas cu 1N. soluția acidului în care este redus electrodul de platină care este în contact cu gazul de hidrogen. care este sub presiune P = 101,3 kPa.
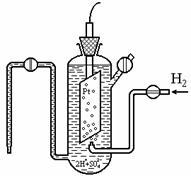
Fig. 7.1. Electrod de hidrogen standard
Electrodul este echilibrat 2H + p + H2 (g). O valoare zero a j pentru acest electrod este determinată de faptul că DG 0 f (H +) = DG 0 f (H2) = 0. Platinum este utilizat datorită inerției sale, ci și pentru că este un catalizator de transfer de electroni (procesul de stabilire a echilibrului accelerează , însă starea de echilibru, adică funcțiile DH, DU, DG, DS, rămâne neschimbată la o temperatură constantă).
Potențialele determinate față de electrodul standard în condiții standard (adică, circa 298) sunt tabelate. Pentru metale, conform datelor chimice (NN Beketov), și apoi prin măsurarea j o 298, s-au stabilit o serie de activități metalice, care au în prezent o serie electrochimică de solicitări metalice (Tabelul 12.1).
Potențiale de electrod standard j 0 ale unor metale
Potențialul electrodului, măsurat în condiții standard
(T = 298 K, [Me n +] = 1 mol / l) față de electrodul hidrogen standard se numește potențialul electrodului standard al metalului și este notat cu j 0. Potențialul electrodului standard este o caracteristică cantitativă a activității chimice a metalului, abilitatea sa de a-si da electronii de valenta si sa treaca in solutie sub forma de ioni.
Proprietățile de bază ale unei serii de solicitări.
Cu cât valoarea j este mai mică, cu atât mai puternică este activitatea de reducere a metalului.
Dacă condițiile diferă de cele standard, formula Nernst este utilizată pentru a calcula potențialul electrodului:
unde j este potențialul electrodului standard al unui metal,
n este numărul de electroni care participă la proces,
F - Constanta Faraday (96500 CI / mol),
R este constanta gazului universal (8,31 Jmol-1 · K-1),
T este temperatura absolută (K).
Dacă înlocuim constantele cu valori numerice în ecuația de mai sus, va avea următoarea formă:
Se poate observa din formula lui Nernst că la o concentrație standard de cation egală cu 1M, φ = j 0. Asta este, potențialul electrodului de echilibru al unui metal este egal cu potențialul său standard.
Articole similare
Trimiteți-le prietenilor: