Din compararea momentelor dipol ale legăturilor rezultă că polaritatea legăturii este mai mare, cu atât este mai mare diferența dintre electronegativitățile atomilor de legătură.
Excepțiile sunt legăturile C-O și C-S, C-F și C-Cl datorită unei creșteri puternice a lungimii legăturii la trecerea de la elementele celui de-al doilea la elementele celei de-a treia perioade:
1.1D <1,56D 1,83D <2,05D
Momentele dipol ale legăturilor multiple sunt mai mari decât cele obișnuite:
Momente de dipol ale legăturilor multiple
Derivarea direcției momentului dipolului poate fi făcută din datele privind electronegativitatea atomilor de legătură: un atom care are o electronegativitate mai mică este capătul pozitiv al dipolului. Cu toate acestea, pentru sistemele conjugate (aromatice) această regulă nu este întotdeauna respectată.
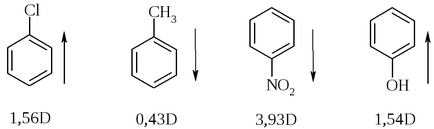
Valoarea momentului dipolului în direcția liniei de comunicație poate fi utilizată pentru o evaluare calitativă comparativă a polarității legăturilor (polaritate relativă).
Încărcare fractionară sau parțială
În chimia organică, termenul "încărcare parțială", "încărcare fracționată" este adesea folosit. Încărcarea parțială este fracția electronului pe atom:
unde L este distanța internucleară (lungimea legăturii covalente), l este distanța dintre centrele de sarcini unitare în dipol și · e este valoarea celei mai mari încărcări parțiale.
Această relație are o natură calitativă, deoarece nu ia în considerare creșterea introdusă în momentul dipolului legăturii de către o pereche de electroni împărțită în comun.
Efectul inductiv
Efectul inductiv (același efect în diverse manuale este de asemenea numit electronic sau polar) este capacitatea substituentului de a-și transmite influența de-a lungul unui lanț de atomi legați covalent. În acest caz, substituentul trăiește, de asemenea, influența restului moleculei la care este atașată.
Transferul influenței substituentului de-a lungul legăturilor σ sau duce la o schimbare a stării electronice a acestor legături: are loc polarizarea lor, care se dovedește a fi diferită în funcție de tipul de legătură.
σ-bond. Se observă o scădere treptată a stării electronice a obligațiunilor:
Polarizarea legăturii dintre atomii de clor și atomii de carbon determină polarizarea inductivă (inductivă) a legăturii C-C vecine; substituentul prezintă un efect inductiv. În cea mai mare măsură, efectul I se manifestă în legătura vecină cu substituentul. Pe măsură ce crește lanțul, inducerea se descompune rapid.
-obligațiuni. Efectul I este polarizarea ± nori. Are loc t-bond-uri izolate.
Dacă substituentul are încărcături ionice sau dipoli, atunci interacțiunea electrostatică poate avea loc nu numai de-a lungul liniilor de legătură, ci și direct prin spațiul sau moleculele solventului. Un astfel de efect al substituentului se numește efect de câmp (efect F). În multe cazuri, este mai important decât efectul I. Closeup ambele efecte sunt dificil de separat, și de multe ori ele sunt reunite sub titlul „efect polar“, „efect electronic“ sau utilizați termenii „efect inductiv“, „efect de câmp“, implicând acțiunea simultană a ambelor efecte. Influența substituenților pe pozițiile de la distanță (1.4 și mai mult) este doar într-o măsură nesemnificativă transmisă prin linia de conexiuni și practic se reduce la influențarea prin spațiu.
Efecte Polar substituent este o valoare bine definită, o măsură a existenței sale depinde de factori structurali ai prezenței și natura celorlalți substituenți în moleculă, solventul și altele. Evaluarea calitativă a I-efect este produs prin compararea efectului substituenților asupra agenților chimici, fizico-chimice, (constantele de ionizare ) sau proprietățile fizice (momente dipolice, RMN) ale compușilor în natură și amploare cu substituentul hidrogen standard: compusul R-X (cu legătura C-X) și compusul standard R-H (cu legătura C-H). .. În acest caz, polaritatea C-H este setat la zero, adică, nu este luată în considerare de dipol mic momentC-H = standardul 0,2-0,4D.H-, un punct de referință; prin urmare, noțiunea de donator și ce este acceptor.
Când substituentul comparat cu hidrogen crește densitatea de electroni de pe lanțul de atomi (inclusiv reduce disponibil în acestea sub influența altor atomi sarcini pozitive), este numit substituent donor de electroni (+ I-substituent) și exponatele + I-efect.
Când substituentul comparat cu hidrogen trage electronii și atomii lanțului sunt încărcați pozitiv (sau există o reducere a circuitului de sarcină negativă, în cazul în care se afla înainte de introducerea substituentului), aceasta se numește un substituent electroatrăgător (-I-substituent) și expune -I -effect.
În realitate, nu există recul sau captarea electronilor, ci pur și simplu o diferență în poziția electronilor de legătură adiaci la substituent, în comparație cu substituentul de hidrogen:
Standard: H-CH2-Ph
Dacă influența substituentului este transmisă numai pe linia legăturilor, atunci ar trebui să se aștepte ca cu cât este mai mare electronegativitatea substituentului. care este localizat la atomul de carbon al lanțului, cu atât este mai mare polarizarea legăturilor și cu atât este mai mare efectul I al substituentului:
Efectele inductive ale diferitelor grupuri în ceea ce privește hidrogenul
Evaluarea semiquantitativă a efectelor inductive
1) Metoda de momente dipol. Dar dacă substituenții au atomi diferiți cu perechi neparticipate, atunci această metodă nu poate fi utilizată, deoarece
Prin valoarea μ, nu se poate trage o concluzie cu privire la semnul efectului polar.
2) Metoda constantelor de ionizare. Cu cât este mai mare efectul-I al substituentului, cu atât mai mult îl delocalizează încărcarea în anion, cu cât anionul este mai stabil și cu atât mai mult Ka (mai puțin decât pKa).
Evaluarea efectelor de inducție ale substituenților asupra constantelor de ionizare ale acizilor acetic substituiți
X-CH2COOH X-CH2COOh + Hg
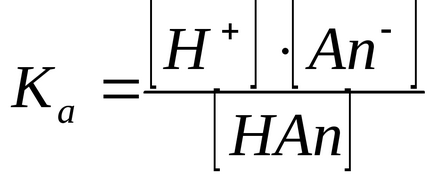
3) Metoda de spectroscopie RMN. Permite evaluarea valorilor relative ale sarcină pozitivă în molecula CH3 X: mai slabă decât semnalul câmp este deplasat protonii grupei metil, cu atât mai mult dezekranirovano de bază, adică mai atras de ea valență electroni ... Într-adevăr, există o corelație bună între schimbarea chimică și electronegativitatea.
Comparația substituenților încărcați și neîncărcați
Atomii încărcați (grupuri) prezintă un efect mai puternic decât atomii neîncărcați:
Atomii (substituenții) încărcați negativ prezintă efectul semnului opus în comparație cu aceiași atomi (substituenți) într-o stare neîncărcată:
Pentru un atom încărcat negativ, efectul I este cel mai mare, cu cât electronegativitatea este mai mică, adică, cu atât este mai mică încărcarea nucleului atomic în perioada:
și cu cât este mai mare încărcătura nucleară și raza atomului din grup:
Pentru grupările hidrocarbonate (alchil) + efectul I crește în serie:
Efectul I crește în aceeași serie ca și electronegativitatea carbonului hibridizat:
-I: sp 3 adică, cu cât este mai mare fracțiunea s-orbitalilor, cu atât efectul inductiv negativ este mai mare. În general, efectul substituenților asupra stării legăturilor σ este de obicei nesemnificativ și de obicei nu este prezentat specific în formule.
Trimiteți-le prietenilor: