CARACTERUL ELECTRIC PRIN METODA DE ELECTROLIZĂ
Echipament: o sursă de curent constant, o celulă cu electrozi de un set de „electrolit“ voltmetru de laborator, rezistor cântare cu greutăți sau chei electronice, cabluri de conectare, o soluție de cupru-ku Poros, cronometru (sau un ceas cu o mâna a doua).
EXPLICAȚII PENTRU MUNCĂ. Pentru a determina încărcarea unui electron, se poate folosi legea de electroliză a lui Faraday, unde m este masa substanței eliberate la catod; M este masa molară a substanței; n este valența substanței; e este sarcina de electron; Na este constanta lui Avogadro; Eu sunt curentul din electrolit; # T1 - timpul de trecere a curentului prin electrolit.
Din această formulă este clar că, pentru a atinge scopul lucrării, este necesar să se cunoască masa molară a substanței eliberate la catod, valența sa și Avogadro constant. În plus, în cursul experimentului, este necesar să se măsoare curentul și timpul cursei sale și, după terminarea electrolizei, masa substanței eliberată la catod.
Pentru a efectua experimentul, se utilizează o soluție apoasă saturată de sulfat de cupru, care se toarnă într-o cuvă cu doi electrozi de cupru. Un electrod este fixat rigid în centrul cuvei, iar celălalt (detașabil) - pe perete.
Soluția apoasă este disociată molecule nu numai de sulfat de cupru (CuS04 = Cu2 + +), dar, de asemenea, apa (H20 = H + + OH -), deși într-o măsură mai mică. Astfel, în soluția apoasă de CuS04 există ioni pozitivi Cu2 + și H +, precum și ioni negativi S02- și OH-. Dacă se creează un câmp electric între electrozii, ionii pozitivi se vor deplasa la catod, iar ionii negativi se vor deplasa la anod. Catodul este potrivit pentru ionii Cu2 + și H +, dar nu toți sunt descărcați. Acest lucru se datorează faptului că atomii de cupru și hidrogen trec ușor în ioni încărcați pozitiv, pierzându-și electronii externi. Dar un ion de cupru atașează mai ușor un electron decât un ion de hidrogen. Prin urmare, ionii de cupru sunt evacuați la catod.
Ionii negativi și OH - se vor deplasa la anod, dar nici unul dintre ei nu va fi descărcat. În acest caz, cuprul va începe să se dizolve. Acest lucru se datorează faptului că atomii de cupru dona mai ușor electroni la o porțiune de circuit electric extern decât ionii și OH -, și devenind ioni pozitivi vor trece în soluție: Cu = Cu2 + + 2e-.
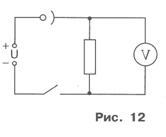
Astfel, atunci când electrozii sunt conectați la o sursă de curent constant în soluția de sulfat de cupru, va avea loc mișcarea direcțională a ionilor, ceea ce va conduce la separarea cuprului pur pe catod.
Pentru ca stratul de cupru liber să fie dens și bine reținut la catod, se recomandă efectuarea electrolizei cu un curent de rezistență redusă în soluție. Și deoarece acest lucru va conduce la o eroare mare de măsurare, se utilizează un rezistor și un voltmetru în locul unui ampermetru de laborator. În funcție de voltmetrul U și rezistența rezistorului R (indicat pe carcasa acestuia), curentul este determinat. I / Diagrama schematică a configurației experimentale este prezentată în figura 12.
Curentul din electrolit se poate schimba în timpul experimentului, astfel încât valoarea medie a sarcinii este dată în formula pentru determinarea încărcării. Valoarea medie a intensității curentului este determinată prin înregistrarea la fiecare 30 de secunde pe toata perioada citirilor voltmetru Length-SRI de observare, atunci lor sum-miruyut și valoarea rezultată este împărțită la numărul de măsurători. Deci, găsiți Ucp. Apoi, în conformitate cu legea lui Ohm, Icp se găsește pentru regiunea circuitului. Este mai convenabil să înregistrați rezultatele măsurătorilor de tensiune într-o masă auxiliară.
Timpul debitului curent este măsurat cu un cronometru.
PROCEDURA DE PREGĂTIRE PENTRU MUNCĂ
1. Indicați care sunt cantitățile fizice care urmează să fie măsurate direct pentru a determina încărcarea electronică prin metoda utilizată în această lucrare. Ce instrumente de măsurare vor fi utilizate? Determinați și înregistrați limitele erorilor absolute ale acestor instrumente.
2. Determinați și înregistrați limitele erorilor absolute ale citirii atunci când utilizați un cronometru mecanic, voltmetru și echilibru.
3. Notați formula pentru determinarea marjei absolute de eroare # 8710;
4. Pregătiți un tabel pentru a înregistra rezultatele măsurătorilor, erorilor și calculelor.
Pregătește o masă auxiliară pentru înregistrarea citirilor voltmetrului.
RĂSPUNSURI ÎNTREBĂRI
De ce timpul de curgere curent în electrolit afectează eroarea în rezultatul măsurării încărcării electronice?
Cum influențează concentrația unei soluții rezultatul măsurării încărcării electronice?
Care este valența cuprului?
Care este masa molară a cuprului?
Care este Avogadro constant?
ORDINEA DE PERFORMANȚĂ
1. Determinați masa electrodului detașabil m1 pe balanță.
2. Atașați electrodul pe celulă și asamblează circuitul electric se pare în Figura 12. Se observă că electrodul are Xia detașabil conectat la polul negativ al sursei de tensiune.
3. Umpleți cuva cu o soluție de sulfat de cupru, închideți cheia și înregistrați citirile voltmetrului la fiecare 15 secunde timp de 15 minute.
4. După 15 minute, deblocați cheia, dezasamblați lanțul, îndepărtați electrodul, uscați și determinați masa m2 împreună cu cuprul care sa stabilit pe el.
5. Calculați masa cuprului eliberat: m- și limita erorii absolute a măsurării sale # 8710;
6. Calculați valoarea medie a tensiunii pe rezistența Ucp și valoarea medie a curentului în electrolit I cf.
7. Calculați încărcarea electronică e.
8. Calculați limita erorii absolute în determinarea încărcării electronice # 8710;
9. Înregistrați rezultatul determinării taxei luând în considerare marja erorii absolute.
10. Comparați încărcarea unui electron determinat din rezultatele experienței cu o valoare tabelară.
Trimiteți-le prietenilor: