Receptorul insulinei (IR) (insulina receptorilor Eng.) - receptor transmembranar. care este activat de insulină. IGF-I. IGF-II aparține unei clase mari de receptori tirozin kinaze [1]. Metabolic, insulina receptorilor joaca un rol-cheie în reglarea homeostaziei glucozei, proces functional, care, în condiții degenerative pot duce la o serie de manifestări clinice, inclusiv a cancerului si a diabetului zaharat [2] [3]. insulina receptorilor Biochimic este codificată de o singură genă INSR, secționarea alternativă în timpul transcripției care produce fie IR-A sau izoforma IR-B [4]. Evenimentele ulterioare posttranlație fiecare izoformă conduce la formarea α proteolytically-divizat și p-subunități care, atunci când sunt combinate, în cele din urmă va capabile dimerizării pentru a da disulfura legata de greutate al receptorului insulinei transmembranar ≈ 320 kDa [4].
Initial transcrieri INSR variante alternative splicing ale genei sunt traduse pentru a produce unul din doi izomeri monomeric: IR-A, în care exonul 11 este tăiat și IR-B, în care exonul este exonul 11. Includerea 11 până la 12 rezultate aminoacizi în adăugarea de mai sus un situs proteolitic furin divizare.

Schema de codificare a culorilor receptorilor de insulină
Când dimerizarea receptorului, după scindarea proteolitică a Lanțurile p a- și, sunt încă 12 aminoacizi la capătul C-terminal al α-lanț (denumită αCT), în cazul în care acestea afectează probabil interacțiunea dintre receptor și ligand [5].
Fiecare monomer izomeric este structurat în 8 domenii diferite; îmbogățit cu leucină repetă domeniu (L1, resturile 1-157) o regiune bogată în cisteină (CR, resturile 158-310), suplimentare de îmbogățit cu leucina repetă domeniu (L2, resturile 311-470), trei fibronectină de tip III domenii; FnIII-1 (resturile 471-595), FnIII-2 (resturile 596-808) și FnIII-3 (resturile 809-906). În plus, domeniul de inserție (ID, resturile 638-756) situate în interiorul FnIII-2, care conține un situs de clivaj α / β furin, care acționează ca proteoliza în domeniile IDα și IDβ. Β-lanț, sub zona FnIII-3 este helixul transmembranar și regiunea juxtamembranară intracelular, direct deasupra domeniului intracelular catalitic al tirozin kinazei responsabile pentru activarea căilor de semnalizare intracelulară [6]. Prin separarea monomerului corespunzător a și homo- receptor lanț β sau heterodimerizeze prin punți disulfidice covalente între monomeri și formează două legături disulfurice, fiecare extinzându-se din α-lanțului într-un dimer. Structura generală a ectodomainului 3D [en]. are patru situsuri de legare la ligand, se aseamănă cu un V. inversata Fiecare monomer este rotit de aproximativ 2 ori în jurul unei axe care se extinde în paralel cu un V. L2 inversat și FNIII-1 domenii ale fiecărui monomer care formează partea superioară a V inversat [6] [7].
Liganzii endogeni ai receptorului de insulină includ insulina. IGF-I și IGF-II. Legarea ligandului la lanțurile ectodomain α-IR determină modificări structurale ale receptorilor, conducând la diferite autofosforilarea resturilor de tirozină în domeniul intracelular în TK β-chain. Aceste modificări contribuie la recrutarea anumitor proteine adaptoare [ro]. proteine cum ar fi substrat receptorilor de insulina (IRS), în plus față de SH2-B [en] (Src Omologul 2 - B), APS și fosfatazele de proteine, cum ar fi PTP1B [en]. în cele din urmă, contribuind la procesele ulterioare asociate cu homeostazia glucozei în sânge [8].
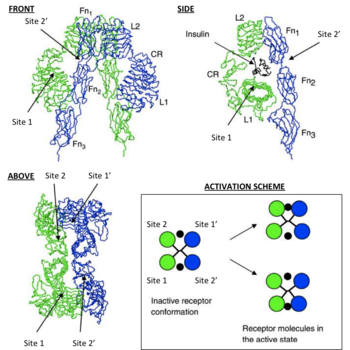
O diagramă care descrie posibilitățile de legare la IR
Strict vorbind, relația dintre receptorul de insulină și ligand prezintă proprietăți complex alosterice. Acest lucru este indicat de Scatchard programul [en], care arată că valoarea măsurată pentru receptorul de insulina, legat la un ligand, în raport cu ligandul nelegat nu trebuie să fie o funcție liniară în raport cu modificările concentrațiilor receptorilor de insulina asociate cu ligandul, oferind un motiv să se presupună că receptorul de insulină și ligandul său este reacționat la mecanismul este legat de cooperare [en] [9]. În plus, observația că rata de disociere crește-IR ligand cu adăugarea de ligand nelegat sugerează că natura acestei cooperări este negativ; Cu alte cuvinte, legarea inițială a ligandului cu IR inhibă legarea în continuare cu un al doilea sit său activ, demonstrând inhibarea allosteric [9].
Deși mecanismul exact de legare a IR cu ligandul său nu este încă elucidat structural din punct de vedere al biologiei sistemice. predicția cinetică biologic semnificativă [en] ligand IR (insulină / IGF-I) a fost determinată în contextul structurii ectodomainelor disponibile în prezent IR [6] [7].
Aceste modele susțin că fiecare monomer IR are 2 situsuri de legare la insulină; Site 1, care este asociat cu suprafața "clasică" de legare a insulinei. constând din L1 plus αCT domeniu și situsul 2 constând din buclele la intersecția FnIII-1 și FnIII-2, a prezis de a se lega la site-ul „nou“ față de insulina hexametrică legarea [1]. Deoarece fiecare monomer furnizează ectodomain IR reprezentare 3D «oglindă“ complementaritate, site-ul N-terminal 1 al unui monomer în cele din urmă se confruntă cu site-ul C-terminal 2 al doilea monomer, care este valabil și pentru fiecare complement monomeri în oglindă (partea opusă a structurii ectodomeniu) . Literatura curenta diferentiaza adăugări site-uri de legare, atribuindu site-1 și situri adaosurile 2 monomeri ca 3 și 4 sau ca site-ul 1 „și 2“, respectiv [1] [10].
Astfel, aceste modele susțin că fiecare IR se poate lega la molecula de insulină (care are două suprafețe de legare) în 4 locuri de situri 1, 2, (3/1 „) și (4/2“). Deoarece fiecare site 1 cu care se confruntă cu proximală locul 2 este prezis să se întâmple situsul de legare a insulinei specific „capsarea» [en] de ligand între monomeri (adică [monomerice 1 Site 1 - Insulina - monomer 2 site (4/2 ' )] sau [1 site monomer 2 - Insulina - 2 situs monomer (3/1 „)]). În conformitate cu modelarea matematică a cineticii IR-insulină, există două implicații importante pentru legarea încrucișată a evenimentelor de insulină; 1. În observația de mai sus a IR interacțiune negativă și ligandul său la legarea ligandului la declinul IR și 2. expunerea fizică duce la reticulare ectodomeniului într-o conformație care este necesară pentru debutul evenimentelor fosforilarii intracelulare de tirozină (adică acele evenimente sunt cerințe pentru activarea receptorului cu urmată de menținerea homeostazei glucozei din sânge) [8].
Receptori tirozin kinază [ro]. inclusiv receptorul de insulină, își mediază activitatea, provocând adăugarea unei grupări fosfat la tirozine specifice în celulele anumitor proteine. Proteinele „substrat“, care sunt fosforilate de către receptorul de insulină cuprinde o proteină numită «IRS-1" pentru„substrat receptorilor de insulina 1“. Legarea și fosforilarea IRS-1 în cele din urmă conduce la o creștere a moleculelor cu afinitate crescută transportorului glucozei (GLUT4) în membrana externă a sensibilității la insulină a țesuturilor, inclusiv celulele musculare si tesutul adipos. și, în consecință, la o creștere a absorbției de glucoză din sânge în aceste țesuturi. Cu alte cuvinte, veziculele GLUT4 transportatorul de glucoza-transportate de la celula la suprafața celulei unde poate medieze apoi transportul glucozei în celulă.
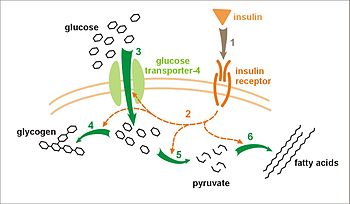
Influența insulinei asupra absorbției și metabolizării glucozei. Insulina se leagă de receptorul său (1), care la rândul său declanșează mai multe cascade de activare a proteinei (2). Acestea includ: translocarea transportorului Glut-4 la membrana plasmatică și influxul de glucoză (3), sinteza glicogenului (4), glicoliza (5), sinteza acizilor grași (6).
Activitatea principală de activare a receptorului de insulină este de a induce absorbția de glucoză. Din acest motiv, „insensibilitate la insulină“ sau reducerea în semnalizarea receptorilor de insulina duce la diabet de tip 2 - celule sunt în imposibilitatea de a lua ca rezultat al glucozei și - hiperglicemie (creșterea glucozei circulație) și toate consecințele diabetului.
Câțiva pacienți cu mutație homozigotă a genei INSR au fost descriși că au primit sindromul Donohue [en]. Această tulburare autosomală recesivă face ca receptorii de insulină să fie complet nefuncționali. Acești pacienți au urechi mici, adesea bombate, nări, buze îngroșate și o întârziere de creștere severă. În majoritatea cazurilor, prognosticul pentru acești pacienți este extrem de sărac, rata mortalității apare în primul an de viață. Alte mutații ale aceleiași gene generează un sindrom Robson-Mendenhall mai puțin sever [en]. în care pacienții au dinți anormali caracteristic, gingiile hipertrofate și mărirea glandei pineale. Ambele boli reprezintă o fluctuație a nivelului de glucoză: după consum, glucoza este inițial foarte mare și apoi scade brusc la niveluri anormal de scăzute [11].
Reglarea exprimării genelor
IRS-1 activat acționează ca un mesager secundar în celulă pentru a stimula transcripția genelor reglementate cu insulină. Mai întâi, proteina Grb2 leagă restul de P-Tyr IRS-1 în domeniul său SH2 [en]. Grb2 devine capabil să lege SOS, care, la rândul său, catalizează înlocuirea PIB-ului legat cu GTP în proteina G-Ras. Aceasta proteina începe apoi o cascadă de fosforilare, ceea ce duce la activarea protein kinazei mitogenoaktiviruemoy (MAPK), care intră în nucleu și fosforilează diverse factorii de transcripție nucleară (de exemplu, Elk1).
Stimularea sintezei glicogenului
Sinteza glicogenului este, de asemenea, stimulată de un receptor de insulină cu IRS-1. În acest caz, acest domeniu SH2 [en] PI-3 kinazei (PI-3K [en]), care se leagă P-Tyr a IRS-1. Acum activați PI-3K poate converti fosfatidilinozitol membrană lipidică 4,5-bifosfat [en] (PIP2) la fosfatidilinozitol 3,4,5-trifosfat [en] (PIP3). Aceasta activează indirect proteina kinaza PKB (Akt) prin fosforilare. PKB fosforilează apoi mai multe proteine țintă, inclusiv glicogen sintaza kinaza 3 [en] (GSK-3). GSK-3 este responsabilă pentru fosforilarea (și, prin urmare dezactivarea) glicogen sintetazei. Când fosforilată de GSK-3, acesta este dezactivat și a împiedicat dezactivarea glicogen sintetazei. Această insulină mod circular crește sinteza glicogenului.
După ce molecula de insulină se conectează cu receptorul și o activează, poate fi eliberată în mediul extracelular sau poate fi degradată în celulă. Degradarea implică de obicei endocitoză a complexului de insulină-receptor, urmată de acțiunea unei enzime care distruge insulina. Cele mai multe molecule de insulină sunt degradate în celulele hepatice. Sa estimat că o moleculă tipică de insulină a degradat aproximativ 71 de minute după eliberarea inițială în sânge [12].
Articole similare
Trimiteți-le prietenilor: