numărul de purtători ai mutației. Frecvența medie a erorilor necorectate este de 1 pentru 10 10
Atât proteina cât și acidul nucleic sunt biopolimeri, adică biologice macromolecule. Ele constau din multe (multe mii) "legături" legate - monomeri.
Monomerii din acești compuși chimici sunt diferiți. Proteinele sunt compuse din aminoacizi, acizii nucleici sunt compuși din nucleotide.
Proteinele au o mare varietate de funcții, iar pentru acizii nucleici numai 2 (transfer genetic și punerea în aplicare a informațiilor genetice și a sintezei proteinelor). Cu toate acestea, fără secvența de nucleotide, este imposibil să se reproducă secvența de aminoacizi din proteină.
9. Asemănări și diferențe în structura proteinelor și a carbohidraților
Ele au o structură polimerică (polimeri complexe sau policondensați), constând din mulți monomeri. Proteinele monomere sunt diverși aminoacizi (NH2-CHR-COOH).
Ca parte a oricărui aminoacid la același atom de carbon alăturat cu două grupări puternic încărcate (gruparea amino NH2 + și gruparea carboxil COOH), aminoacizi, datorită proprietăților lor pot lua parte la reacții chimice complexe, inclusiv în formarea de polimeri lungi. Proteinele sunt elementul funcțional principal al oricărui organism. Toate creaturile vii în formarea proteinelor au implicat 20 de aminoacizi de bază. Dimensiunea medie a proteinei este de aproximativ 300 de aminoacizi. funcția specifică a unei proteine este determinată de secvența sa de aminoacizi.
1 - nu purtați nicio încărcătură (reziduuri de hidrocarburi)
2 - radicali cu încărcături electrostatice slabe (grupări hidroxil, carbonil, tio)
3 - având o încărcătură puternică pozitivă (gruparea amino)
4 - încărcare negativă puternică (grupul carboxil, fosfat)
Moleculele de proteine pot avea foarte multe proprietăți chimice complexe și pot efectua foarte multe funcții complexe.
Datorită particularităților structurii sale chimice, proteinele sunt extrem de diverse în ceea ce privește proprietățile chimice și funcțiile efectuate în organism
realizate numai de proteine:
1. catalizator (enzimatic);
1. transport pasiv (pe gradient) - canal;
2. transport activ - pompă cu membrană;
4. motor (actin, myosin);
8. Construcții (keratină);
3) structura primară - secvența aminoacizilor;
4) structura secundară: # 945; - spirala;
- # 946; - listele. (numeroase legături slabe de apă, datorate cărora există o răsucire în structuri secundare)
3) structura terțiară - molecule tridimensionale formate din cauza încărcărilor proprii neutilizate. Legăturile hidrofobe sunt slabe, dar stabile în detrimentul cantității. Legătura S-S este puternică, capabilă să lege moleculele și să formeze o structură terțiară;
4) structura cuaternară (complexe moleculare). Un exemplu clasic este Hemoglobina (Se compune din 2 molecule # 945; -globină, 2 molecule # 946; globină, gemă și ion de fier.)
Din structura secundară începe conformarea moleculelor sub temperatura. Factorul care îl afectează este concentrația de ioni diferiți. Prin schimbarea conformației sale, proteina poate rămâne într-o stare stabilă. Schimbarea conformației afectează proprietățile chimice ale moleculei - capacitatea de a efectua funcția necesară.
Spre deosebire de grăsimi și carbohidrați, proteinele au o mare diversitate structurală => funcțiile biologice ale proteinelor sunt, de asemenea, izbitoare de diversitate.
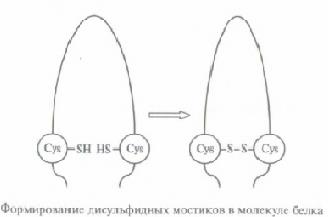
Una din cele 20 de variante de aminoacizi utilizate în compoziția de proteine este cistina (Cys). radical său conținând o grupare SH funcțională. Dacă două reziduuri cistina în structura terțiară sunt apropiate unul de altul, între ele, sub acțiunea unei anumite enzime poate fi o punte disulfură S.Takie S-poduri acționează ca cuple, stabilizarea structurii terțiare a moleculei de proteină.
Funcțiile unei molecule specifice de proteine depind nu numai de secvența de aminoacizi, ci și de conformația sa la un moment dat. (de exemplu, o modificare a conformării moleculelor de proteine cu o temperatură ridicată duce la inactivarea ireversibilă a proteinei (ou fiert)).
Schimbarea în celule a concentrației unor ioni, corpul este capabil să regleze activitatea biologică a proteinelor proprii. (cristale de sare pe albus de ou - pete tulburi - inactivarea temporară a proteinelor).
Proteinele sunt compuși polimerici. Și printre carbohidrați pot fi și polimeri (de exemplu carbohidrați complexi - amidon, glicogen, celuloză, chitină).
Atât proteinele, cât și carbohidrații au o funcție structurală (proteinele - scheletul celular al animalelor, carbohidrații - peretele celular)
Carbohidrații și proteinele au o caracteristică de protecție este proteine active (imunoglobuline) și ale corpului de protectie pasiva in Carbohydrate (intareste peretii celulelor chitina datorate și celuloză).
Diferiți monomeri. La proteine - aminoacizi, astfel, ele pot fi diferite, iar la legăturile de carbohidrați H-C-ON. În carbohidrați, structura este mai simplă decât cea a proteinelor, proteinele au o mare diversitate structurală.
Carbohidrații datorită structurii lor monotone pot efectua numai funcțiile de rezervă și energie, în timp ce funcțiile de proteine sunt izbitoare de diversitate.
Proteinele sunt polimeri complexe, iar carbohidrații pot fi polimeri sau pot să nu fie.
Atât proteinele, cât și carbohidrații au o funcție de depozitare (proteinele au cazeină, carbohidrații au amidon și glicogen)
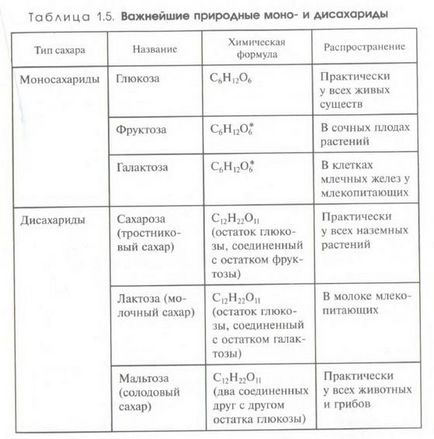
Substanțe organice care conțin o grupare carbonil și mai multe grupări hidroxil. Ele sunt substanțe hidrofile. multe (OH), multe dintre ele fiind solubile în apă (zahăr).
1. Monozaharidele (un lanț mic (3≤n≤7) cu mai multe funcționale H-C-OH): glucoza (C6H12O6) - monozaharidă ciclică se datorează faptului că moleculele sale sunt închise într-un inel printr-un atom de O2; fructoză, galactoză (izomeri).
2. dizaharide (monozaharide cu 2 inele, conectate unele cu altele printr-un atom de oxigen): zaharoză (C12H22O11); (zaharoză = glucoză + fructoză)
3. Polizaharide. constau din numeroase reziduuri de monozaharide), amidon, glicogen, celuloză, chitină. Datorită dimensiunii mari a moleculelor lor, polizaharidele sunt practic insolubile în apă și nu au un gust dulce.
Toți carbohidrații sunt aranjați mai mult sau mai puțin uniform, deci funcțiile lor sunt relativ simple și de același tip.
1. Energie. (energie datorată oxidării glucozei)
C6H12O6 + O2 → CO2 + H2
O + E (ATP) → lumină, căldură, mecanică, electrică,
sinteza altor conexiuni.
2. Rezervă. (stocul de substanțe în multe organisme este reprezentat în principal de polizaharide, la animale și ciuperci polizaharidă - glicogen)
3. Construcția (polizaharidele formează baza pereților celulari)
Trimiteți-le prietenilor: