Așa cum am menționat deja mai sus, moleculele constau din atomi. Câți atomi din diferite specii sau, așa cum se numesc, elemente chimice.
În prezent, sunt cunoscute 102 de elemente care umple celulele sistemelor periodice de elemente ale lui DI Mendeleev.
Toate substanțele pe care le vedem în lumea înconjurătoare se formează ca rezultat al interconectării în diferite combinații ale acestor elemente chimice (atomi).
Pentru comoditatea scrierii compoziției chimice a diferitelor substanțe și interacțiunea lor chimică dintre o substanță chimică acceptată în legenda fiecărui element sunt formate din literele inițiale ale denumirilor latine ale acestor elemente.
Limba latină, care a fost inițial o limbă vorbită de Roma antică, și apoi în tot Imperiul Roman și mai târziu, după prăbușirea Imperiului Roman, a continuat să fie folosite de oamenii de știință din Evul Mediu, iar în unele științe, a rămas până în prezent.
Deci, în medicină folosesc limba latină pentru numele de boli și medicamente, în botanică - pentru numele plantelor.
Când sunt familiarizați cu aspectele legate de tratarea apei, cele mai multe întâlniri sunt cele mai multe întâlnite:
Cu ajutorul acestor simboluri (simboluri) de elemente chimice, este posibil să se prezinte molecule de orice substanță, precum și diverse procese chimice.
Figura din colțul din dreapta jos al simbolului indică numărul de atomi din moleculă. De exemplu, reacția chimică a combustibilului ars într-un cazan cu abur poate fi desemnată după cum urmează:
carbon oxigen este dioxid de carbon, și se citește astfel: plus două este egală cu două.
Ipotezele inițiale ale oamenilor de știință despre atom ca o particulă mică de materie indivizibilă s-au dovedit a fi greșite. În prezent, particulele elementare mai mici sunt descoperite de fizicieni, dintre care toți atomii sunt construiți. Există trei astfel de particule de bază: protoni, neutroni și electroni.
Conform cercetărilor din ultimele decenii, în plus față de aceste particule de bază de diferite deschise in mai multe particule mai mici (pozitroni, fotoni, neutrini, mezoni, și altele.), Care decurg din dezintegrările radioactive și transformări ale materiei.
Cum se formează atomul din aceste particule? În centrul fiecărui atom este nucleul său, format din protoni și neutroni. În jurul nucleului, electronii se rotesc la diferite distanțe (orbite), care sunt cele mai ușoare dintre aceste trei tipuri de particule.
Greutatea electronului este de 10-27 g. Protonul și neutronul au aproape aceeași greutate, de aproximativ 1850 ori mai greu decât electronul. Dimensiunile protonilor, neutronilor și electronilor sunt exprimate în sute de mii de un angstrom.
Dimensiunea orbitei exterioare rotative de electroni și care este în mod substanțial dimensiunea unui atom ca întreg, este cuprins între 1 și 4, A. Prin urmare, cea mai mare parte din volumul atomului este gol, nu este umplut cu substanțe.
Dar nu vedem nu numai atomi, ci și molecule și, prin urmare, trupurile din jurul nostru par a fi construite din materie solidă.
Cea mai mare parte a atomului este concentrată în nucleu. Dacă am putea umple un 1 cm 3 protoni și neutroni cât mai ferm acestea sunt situate în nuclee de atomi, atunci greutatea cubului ar fi egal cu aproximativ greutatea de cel mai înalt munte Elbrus caucaziană. O asemenea densitate are importanță în intestinul unor stele.
Protonul și electronul au opuse, dar egale în încărcături electrice: protonul are o sarcină pozitivă, electronul are o încărcătură negativă. Neutronii nu au o încărcătură electrică.
Deoarece atomul ca întreg este neutru, numărul de electroni care se rotesc în jurul lui este egal cu numărul de protoni din acest nucleu. Astfel, toate cunoscute diverse elemente chimice diferă unul de altul în numărul lor sunt încărcate pozitiv protonii nucleii și o cantitate egală, respectiv rotirea în jurul lor în diferite orbite ale electronilor.
În Fig. 3 prezintă diagrame simplificate ale structurii atomilor anumitor elemente.
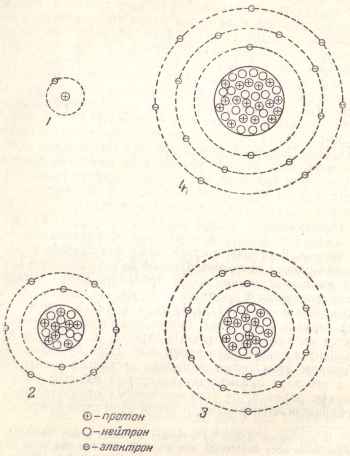
Fig. 3. Schemele simplificate ale structurii unor atomi: 1 - hidrogen; 2 - oxigen; 3 - sodiu; 4 - clor.
Atomul de hidrogen are un electron și, prin urmare, există un proton în nucleul său. Nucleul atomului de oxigen sunt opt protoni și opt electroni îl înconjoară, din care doi electroni se învârt în lungul interiorului primei orbite, iar sase electroni - pe partea exterioară a doua orbita.
Sodiu Y având un miez 11 și același număr de protoni electroni cele mai recente distribuite pe trei orbite: primii - doi electroni (precum și la atomul de oxigen), al doilea - opt electroni și al treilea, exterior, - un electron.
atom de clor cu protoni din nucleu 17 are: doi electroni în prima orbita la a doua opt orbita electronilor (aceeași ca și cea a oxigenului și sodiu) și șapte electroni în a treia orbită.
Se constată că în fiecare orbită se poate găzdui doar un anumit număr limitator de electroni. Prima orbită care înconjoară nucleul poate conține numai doi electroni, al doilea - opt, al treilea - optsprezece, al patrulea - treizeci și doi, al cincilea - optsprezece și așa mai departe.
Mai mult, fiecare orb următoare poate avea un electron numai dacă toate orbitele anterioare sunt umplete la maxim. Se constată că toate proprietățile chimice ale elementelor sunt determinate de localizarea electronilor și în primul rând de electronii localizați pe orbita exterioară.
Această dependență a fost ingenios pentru a anticipa marele om de știință rus Mendeleev în sistemul său periodic al elementelor, în care numărul de secvență indică poziția numărul elementului de electroni per atom. și în aceeași coloană a mesei există atomi cu același număr de electroni în orbita exterioară.
Deoarece cea mai mare parte a atomului este concentrată în nucleu, greutatea sa este determinată aproximativ de greutatea nucleului, constând din protoni și neutroni. Greutatea neutronului este puțin diferită de greutatea protonilor.
Numărul de neutroni din nucleul unui atom este egal sau mai mare decât numărul de protoni. Astfel, greutatea unui atom este determinată de numărul total de protoni și neutroni din nucleu și, prin urmare, este numit numărul de masă al atomului.
În prezent sunt determinate greutățile absolute ale diferiților atomi, sunt exprimate prin cantități extrem de mici. De exemplu, dacă luăm chiar și cel mai greu atom - uraniu, atunci greutatea sa este de numai 0,4 x 10 - 21 g.
Bineînțeles, tratarea unor astfel de cantități în calcule este foarte incomodă. Prin urmare, în chimia convențională a adoptat o măsură specială a ponderii atomilor, egală cu greutatea cea mai ușoară dintre ele - atomul de hidrogen, a căror greutate se presupune a fi de 1,0, și apoi greutatea tuturor celorlalți atomi arată de câte ori acestea sunt mai grele decât atomul de hidrogen.
În prezent, unitatea de greutăți atomice adoptate 1/16 greutatea atomică a oxigenului, care este mai convenabil, deoarece în acest caz greutățile atomice ale multor elemente sunt aproape de întregi. Dar atunci masa atomică a hidrogenului în sine este egală cu 1,008; pentru calculele aspre poate fi egal cu 1,0.
Articole similare
Trimiteți-le prietenilor: