Modelul lui Thomson
Primul model al structurii atomului a fost propus de către J. Thomson în 1904, conform căruia atomul este o sferă încărcată pozitiv cu electroni încorporați în ea. În ciuda imperfecțiunii, modelul lui Thomson a permis explicarea fenomenelor de emisie, absorbție și împrăștiere a luminii de către atomi și, de asemenea, stabilirea numărului de electroni în atomii de elemente luminoase.

Fig. 1. Atom, conform modelului lui Thomson. Electronii sunt ținute în sfera încărcată pozitiv de forțele elastice. Cei care se află la suprafață pot "ieși" cu ușurință. lăsând un atom ionizat.
2.2 Modelul Rutherford
Modelul Thomson a fost dezmințită E. Rutherford (1911), care a arătat că o sarcină pozitivă și aproape toată masa atomică concentrată într-o mică parte din volumul său - un nucleu în jurul căruia se deplaseze electroni (figura 2.).
Fig. 2. Acest model al structurii atomului este cunoscut ca unul planetar, pentru că electronii se rotesc în jurul nucleului ca planetele sistemului solar.
Conform legilor electrodinamicii clasice, mișcarea unui electron de-a lungul unui cerc în jurul nucleului va fi stabilă dacă forța atracției Coulomb este egală cu forța centrifugă. Cu toate acestea, în concordanță cu teoria câmpului electromagnetic, electronii trebuie să se deplaseze într-o spirală, care energizează continuu și să cadă pe miez. Cu toate acestea, atomul este stabil.
În plus, emisia continuă de energie de la un atom ar trebui să fie însoțită de un spectru continuu continuu. De fapt, spectrul atomic constă în linii și serii separate.
Astfel, acest model contrazice legile electrodinamicii și nu explică natura liniară a spectrului atomic.
2.3. Modelul Bohr
În 1913, N. Bohr și-a propus teoria structurii atomului, fără a respinge complet ideile anterioare. Bazat pe teoria sa, Bohr a pus două postulate.
Primul postulat spune că un electron se poate roti în jurul nucleului doar peste anumite orbite staționare. Fiind pe ele, nu radiază sau nu absorb energie (figura 3).
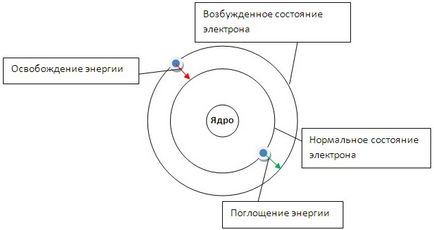
Fig. 3. Modelul structurii atomului Bohr. Modificarea stării unui atom când un electron trece de la o orbită la alta.
Când se deplasează de-a lungul unei orbite staționare, rezerva de energie a electronilor (E1, E2 ...) rămâne constantă. Cu cât orbita este mai aproape de nucleu, cu atât mai puțină energie este stocată în electronul E1 ˂ E2 ... ˂ En. Energia unui electron în orbite este determinată de ecuația:
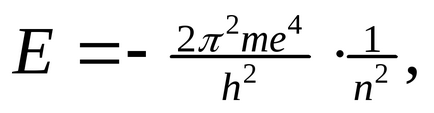
unde m este masa de electroni, h este constanta Planck, n este 1, 2, 3 ... (n = 1 pentru prima orbita, n = 2 pentru a doua, etc.).
Cel de-al doilea postulat spune că în tranziția de la o orbită la alta, un electron absoarbe sau eliberează o cantitate (energie) cuantică.
Dacă expuneți atomi la (căldură, radiație etc.), atunci electronul poate absorbi cuantumul energiei și se poate deplasa la o distanță mai mare de orbita nucleului (figura 3). În acest caz, vorbim despre starea excitată a atomului. Atunci când electronul se întoarce (pe o orbită mai aproape de nucleu), energia este eliberată sub forma unui cuantum de energie radiantă - un foton. În spectru, acest lucru este fixat de o anumită linie. Pe baza formulei
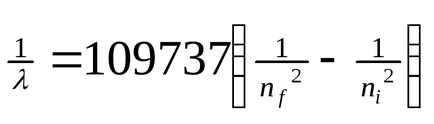
unde λ este lungimea de undă, n = numerele cuantice care caracterizează orbitele apropiate și îndepărtate, Bohr a calculat lungimile de undă pentru toate seriile din spectrul atomului de hidrogen. Rezultatele obținute corespund datelor experimentale. Originea spectrelor liniei discontinue a devenit clară. Ele sunt rezultatul radiației energiei prin atomi în trecerea electronilor de la o stare excitată la o stare staționară. Tranzițiile electronilor la prima orbită formează un grup de frecvențe din seria Lyman, la a doua - la seria Balmer, la a treia serie de Paschen (Figura 4, Tabelul 1).
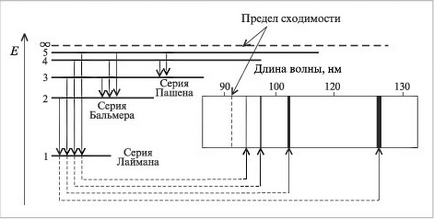
Fig. 4. Corespondența dintre tranzițiile electronice și liniile spectrale ale atomului de hidrogen.
Verificarea formulei Bohr pentru seria spectrului de hidrogen
Articole similare
Trimiteți-le prietenilor: