Reacțiile exoterme sunt reacții care apar odată cu eliberarea căldurii. Reacțiile endotermice sunt reacții care au loc prin absorbția căldurii.
Efectul termic al unei reacții chimice este cantitatea de căldură eliberată sau absorbită ca rezultat al reacției chimice.
Entalpia (H) - aceasta este o anumită proprietate a materiei, este o măsură a energiei acumulate de substanță în timpul formării ei. Este dovedit faptul că, în procesele chimice care au loc la presiune constantă, separată (sau absorbită) este măsură de căldură de reducere (sau, respectiv, în creștere) entalpia reacției, N.
Astfel, pentru reacțiile exoterme, atunci când este eliberată căldura, H este negativă. În reacțiile endotermice (căldura este absorbită) H este pozitivă.
În ecuațiile termochimice de reacție, valorile lui H sunt diferența în entalpiile produselor de reacție și a substanțelor inițiale.
Împreună cu utilizarea entalpiei este egală în magnitudine absolută și opusă valorii semnului, de exemplu:
unde Q este cantitatea de căldură eliberată. Dacă folosim entalpia (caracteristica conținutului energetic al sistemului), atunci această ecuație trebuie scrisă diferit:
Căldura de formare a compusului este cantitatea de căldură care se dezvoltă sau absorbit atunci când un mol de Educație chimică soedineniya.iz substanțe simple, în condiții standard (P = 101,3 Pa, T = 298K). Se măsoară în kJ / mol. De exemplu, căldura de formare a unui mol de apă în stare lichidă de 2 g (mol) de hidrogen și 16 g (0,5 mol) de oxigen este de 285.8 kJ:
Căldura de descompunere a unui compus este cantitatea de căldură care este eliberată sau absorbită prin descompunerea unui mol de substanță în condiții standard. Căldura de descompunere a unui compus dat este egală cu căldura formării sale, dar are semnul opus. Astfel, după descompunerea a 1 mol de apă, se va absorbi 285,8 kJ de căldură:
Căldura de combustie a unui compus este cantitatea de căldură care este eliberată atunci când un mol de substanță arde. De exemplu, căldura de ardere a acetilenei este de 1300 kJ:
H brut = -1300 kJ / mol.
Legea Hess (este numită și legea sumelor efectelor termice). Efectul termic al unei reacții chimice depinde de starea materiilor prime și a produselor de reacție, dar nu depinde de etapele intermediare ale reacțiilor. Consecință a legii Hess: entalpiei standardul de formare este egală cu diferența dintre suma căldurilor de formare a reacției și cantitatea de produse (căldura de formare a materiilor prime ^ sumarea efectuate în conformitate cu numărul de substanțe alunițe care participă la reacție, adică coeficienții stoechiometrici în reacția în desfășurare ecuație .... De exemplu:
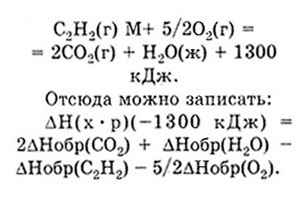
Articole similare
Trimiteți-le prietenilor: