Relația dintre presiunea osmotică și osmolalitate. Osmolaritatea fluidele corporale
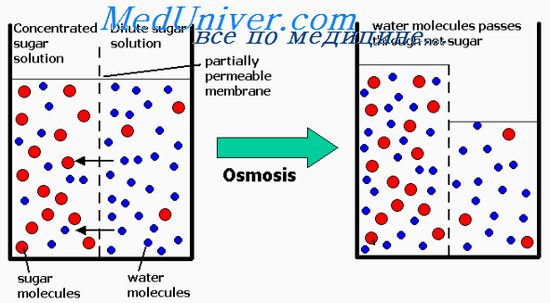
Presiunea osmotică a soluției este direct proporțională cu concentrația particulelor dizolvate în ea. Acest lucru este valabil pentru substanțele dizolvate cu molecule mari și mici. De exemplu, o moleculă de albumină, cu o greutate moleculară de 70.000 creează același efect osmotic ca o moleculă de glucoză, greutatea moleculară este egală cu 180. O moleculă de NaCl, cu toate acestea, posedă două particule active osmotic: ionii de Na + și Cl, efectul osmotic care (în comparație cu albumină sau glucoză) într-o de 2 ori mai mare, astfel încât presiunea osmotică a soluției este proporțională cu osmolaritatea acesteia - reprezintă concentrația particulelor dizolvate.
În conformitate cu articolul van't Hoff osmolaritate (n) poate fi calculat prin formula: a = CRT, unde C - concentrația solutului în osmolitul per litru, R - constanta universală a gazelor și T - temperatura în grade Kelvin (273 ° + Temperatură Celsius). Dacă k este exprimată în unități convenționale pentru fluide biologice - mm Hg, T corespunde unei temperaturi normale a corpului de (273 ° + 37 ° = 310 ° Kelvin), valoarea calculată a I pentru 1 osm / l va fi 19300 mm Hg. Art. Aceasta înseamnă că pentru o concentrație de 1 mosm / litru k este de 19,3 mm Hg. Art. Astfel, fiecare milli-osmol al gradientului de concentrație transmembranară produce o presiune osmotică de 19,3 mm Hg. Art.
Presupunând că membrana este impenetrabilă pentru substanța dizolvată, este posibil să se calculeze posibila presiune osmotică a soluției folosind regula Van't Hoff. De exemplu, presiunea osmotică a unei soluții de NaCl 0,9% se calculează după cum urmează: 0,9% înseamnă că 100 ml soluție conține 0,9 g de NaCI sau 9 g / l. Deoarece greutatea moleculară a NaCI este de 58,5 g / mol, molaritatea soluției este: 9 g / l împărțită la 58,5 g / mol sau 0,154 mol / litru. Deoarece fiecare moleculă de NaCl este echivalentă cu 2 osmole, osmolalitatea soluției este: 0,154x2 sau 308 mosm / litru. În consecință, osmolaritatea soluției este de 308 mosm / l. Presiunea posibilă osmotică a soluției este: 308 moscm / l x 19,3 mm Hg. Art. sau 5944 mm Hg. Art.
Acest calcul este aproximativ, deoarece în soluția datorată forțelor de interacțiune interioară dintre ionii Na + și Cl- nu există o independență totală. Teoretic, valoarea calculată cu ajutorul regulii Van't Hoff trebuie corectată ținând cont de corecția numită coeficientul osmotic. Pentru NaCl este egal cu 0,93. Prin urmare, valoarea reală de osmolaritate a soluției de NaCl 0,9% este de 308x0,93 sau 286 mosm / l. În practică, când se determină osmolaritatea și presiunea osmotică a soluțiilor utilizate pentru perfuzii, corecția pentru coeficientul osmotic este uneori neglijată.
Osmolaritatea fluidele corporale. Să acordem atenție valorilor aproximative ale osmolarității diferitelor substanțe dizolvate în plasmă, fluide intercelulare și intracelulare. Rețineți că aproximativ 80% din osmolaritate totală a fluidului interstițial datorită ionilor de Na + și Cl, în timp ce în osmolaritatea lichidul intracelular aproape jumătate din K + ioni este generat, iar restul este distribuit între ionii altor substanțe.
Osmolaritatea totală a fiecăruia dintre cele trei fluide principale ale corpului este de aproximativ 300 mOsm / l. În comparație cu fluidele intercelulare și intracelulare, osmolalitatea plasmatică este mai mare cu 1 mosm / l. Această ușoară diferență se datorează proteinelor care mențin o presiune mai mare în lumenul capilar (mai mare cu 20 mm Hg) decât în fluidul intercelular din jur.
Corectată osmolaritatea fluidelor corporale. Linia inferioară a tabelului prezintă valoarea corectată a osmolalității plasmei, a fluidelor intracelulare și intracelulare. Motivul introducerii corecțiilor sunt forțele de atracție și repulsie dintre ioni sau molecule în soluție, care determină, respectiv, o ușoară creștere sau o ușoară scădere a "activității" osmotice a substanței dizolvate.
Presiunea osmotică totală a fluidelor corporale. Tabelul prezintă, de asemenea, valorile totale ale presiunii osmotice ale diferitelor fluide măsurate pe părțile opuse ale membranei, cu o parte scufundată în apă distilată. Rețineți că presiunea totală din plasmă este egală cu produsul osmolarității corectate a plasmei (282 mosm / L) cu un factor de 19,3. Ca rezultat, obținem 5443 mm Hg. Art.
Trimiteți-le prietenilor: