Problema tratamentului infecțiilor nosocomiale severe
Rezistența florei
Rezistența infecțiilor nosocomiale de antibiotice (AB) este o cauză importantă un impact asupra consumului de resurse și mortalitate [1]. Creșterea rapidă și răspândirea rezistenței la flora spitalului AB se observă în întreaga lume, dar acest proces este inegal. Gram-negative și Gram-pozitive organisme sunt patogeni majori infecțiilor nosocomiale [2-5]. Microorganismele cele mai problematice sunt rezistente la meticilină bacterii S.aureus (MRSA) și Gram-negative - producători de spectru β-lactamază răspândit (BLSE), deoarece ele au o rezistență la multe AB [6-11].
Unitățile de resuscitare și terapie intensivă (ICU) sunt departamentele cele mai relevante în ceea ce privește apariția rezistenței florei la AB. Aceasta se datorează mai multor motive: 1) frecvența ridicată a terapiei inițiale ineficiente și utilizarea prelungită a antibioticelor cu spectru larg; 2) concentrația celor mai severi pacienți în camere cu o suprafață relativ mică; 3) interesul economic scăzut al asistentelor medicale în formarea și aplicarea practică a metodelor de limitare a răspândirii contactului cu flora rezistentă; 4) o creștere a numărului de pacienți spitalizați cu patologie acută și cronică care necesită tratament pe termen lung și sunt sursa de bacterii rezistente la AB [1, 12-13].
Depășirea rezistenței la AB
Terapia antimicrobiană ideala ar trebui sa ofere terapie adecvata (activ impotriva agentului patogen selectat) de pornire și limita creșterea și răspândirea rezistenței. Mai recent, ideile principale ale unui astfel de program au fost prezentate sub forma a 12 principii de prevenire a rezistenței în spital. Unul dintre elementele-cheie ale acestui program este de a participa la rezolvarea problemelor de experți în domeniu (boli infectioase, epidemiologi clinice, microbiologi, farmacologie clinică), în special în dezvoltarea de metode de optimizare a tratamentului și pentru a limita rezistența la AB.
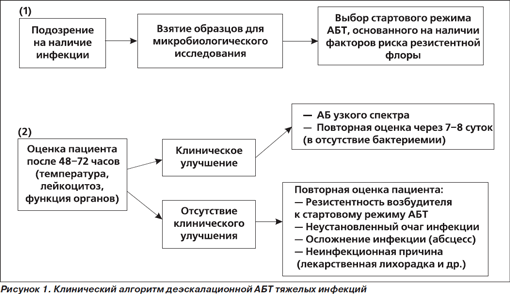
1. Suspiciunea infecției nosocomiale severe.
2. Evaluarea regimului de pornire a ABT după obținerea datelor microbiologice.
3. Finalizarea cursului ABT - monitorizare continuă.
Rezistența la AB: factorii de risc și efectul lor asupra rezultatelor
Factorii de risc pentru apariția rezistenței la AB
AB stimulează apariția rezistenței, prin urmare, măsurile care vizează limitarea utilizării lor sunt direct legate de limitarea rezistenței. Multe studii au evidențiat o relație strânsă între utilizarea anticorpilor și apariția rezistenței bacteriene la acesta [15-17]. Există alți factori de risc pentru creșterea rezistenței la AB: spitalizare prelungită; utilizarea de dispozitive invazive (tuburi de intubație, catetere vasculare), probabil ca rezultat al formării de biofilme pe suprafața acestor dispozitive; șederea în locuințele persoanelor cu handicap și a persoanelor în vârstă; măsuri ineficiente de control al infecțiilor [13].
Apariția de noi tulpini de agenți patogeni în afara spitalelor duce la intrarea acestei flori rezistente în spital. Mai recent, a fost demonstrată apariția și răspândirea tulpinilor de S.aureus rezistente la oxacilină (CA-MRSA) dobândite în comunitate [17-20]. Utilizarea prelungită a AB este cel mai important factor în apariția rezistenței la acesta, iar acest efect poate fi semnificativ slăbit de ABT rațional [21-22].
Consecințe ale ABT inadecvate
Letalitate crescută. Se demonstrează că ABT empirică a infecțiilor severe prin medicamente inactive în ceea ce privește agenții patogeni, adică inadecvată ABT de pornire, duce la o creștere semnificativă a letalității - de aproximativ 2 ori. Recent, date similare au fost obținute la pacienții cu sepsis [23-31]. Schimbarea in pericol viata infectiilor ABT dupa ce a primit datele de studiu microbiologic nu a imbunatati in mod semnificativ rezultatele tratamentului ca urmare a apariției complicațiilor severe: șocul septic, hemoragie și alte cauze [24, 26]. In aceste studii, se arată că rezistența la Spitalul de creștere a florei a dus la o creștere a mortalității datorită eficienței scăzute a modurilor standard de ABT empirice. Recent, recomandările Thoracic Society Americane si Societatea de boli infecțioase (ATS / IDSA) pentru tratamentul pneumoniei nozocomiale a fost subliniată importanța terapiei antimicrobiene inadecvate drept cauza creșterii mortalității intraspitalicești [32]. Aceste linii directoare accentuează importanța: 1) monitorizarea sensibilității florei locale AB (actualizarea continuă a datelor pentru toate spitalele și UTI individuale pentru a asigura caracterul adecvat al alegerii regimurilor empirice terapiei antimicrobiene); 2) dozarea corectă a AB (pentru optimizarea concentrațiilor tisulare).
Creșterea costurilor. costurile asociate cu infecțiile nozocomiale, care sunt de obicei cauzate de o floră rezistentă la AB [17, 33] a crescut Practic. S-a descoperit că infecțiile cauzate de MRSA, comparativ cu infecțiile cauzate de sensibile la meticilina / oxacilina S.aureus (SAMS), sunt responsabile de mortalitate mai mare. Într-o meta-analiza a 30 de studii pe care le-a aratat ca MRSA-bacteriemie, indiferent de alți factori cresc riscul de deces [34]. La evaluarea mortalității atribuite MRSA și MSSA, diferența a fost de aproximativ 25% [35]. Motivele acestor diferențe sunt considerate a fi: 1) severitatea cursului infecției; 2) utilizarea ABT empirică inadecvată. De obicei, pacienții cu infecții cauzate de MRSA, a indicat desigur mai severă a bolii și la momentul admiterii la spital, iar la momentul diagnosticului de infecție. În plus, pacienții au necesitat spitalizare mai lungă.
Factorii care influențează alegerea inițială a ABT
Mod adecvat al ABT. La determinarea regimului ABT empiric, trebuie luați în considerare patru factori importanți: 1) prezența infecției (diagnostic stabilit sau suspectat al bolii infecțioase); 2) probabilitatea semnificației etiologice a anumitor agenți patogeni la anumite tipuri de infecții nosocomiale (structura etiologică a infecțiilor nosocomiale); 3) spectrul microbilor circulanți în această instituție și caracteristicile rezistenței lor la antibiotice (monitorizarea florei locale); 4) pacientul are factori de risc pentru infecția cauzată de flora rezistentă. În mod ideal, toți factorii de mai sus trebuie luați în considerare.
Prezența unei infecții. Multe state critice, însoțite de semne inflamatorii de reacție, clinice și de laborator generalizate care nu diferă în mod semnificativ de semne de infecție. În cazurile de pacienți internați în UTI boli neinfecțioase semne de infecție (focus primar, semne de infecție sistemică, nivelurile crescute de citokine, proteine de fază acută, procalcitonin), de obicei, nu provoacă dificultăți de diagnosticare. Cu toate acestea, în politraumatism sever, arde toxemia, pancreatita distructive, complicații infecțioase chirurgicale postoperatorii, insuficiență multiplă de organ se produce inflamație generalizată, ceea ce creează adesea dificultăți de diagnostic diferențial semnificative în eliminarea infecțiilor nozocomiale și conduce la o creștere semnificativă a utilizării de antimicrobiene, inclusiv un spectru larg.
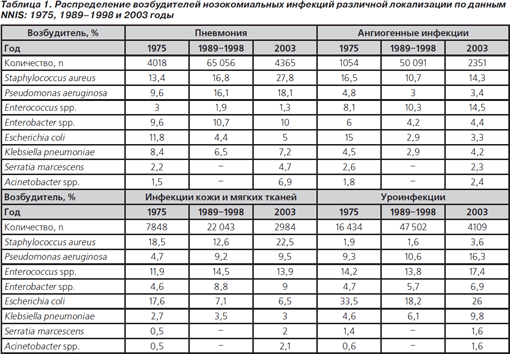
Creșterea numărului și rezistenței bacteriilor gram-negative nefermentate. Una dintre cele mai importante tendințe este creșterea relevanței Acinetobacter spp. la pacienții cu uroinfecții, pneumonie și infecții chirurgicale la nivelul rănilor [39-41]. În ciuda contribuției relative scăzute a acinetobacteriilor (
Monitorizarea florei locale și rezistența la AB
Influența altor factori, inclusiv ventilația mecanică. Prevalența florei multirezistente diferă semnificativ în funcție de patologia pacienților, cum ar fi spitalele și departamentele. agenți patogeni multiresistant cel mai adesea distinse de pacienti grele, pacientii cu boli cronice, cum ar fi pneumonia cu prezența factorilor de risc asociat cu îngrijirea medicală (tabelul. 2) și pacienți cu pneumonie nosocomială tarziu. Factorii de risc pentru NPivL cauzat de flora multirezistentă au fost studiați la 135 pacienți cu ventilație mecanică [17]. Durata ventilației mecanice înainte de pneumonie și numire anterioare AB (în termen de 15 zile înainte de NPivl) au fost factori de risc semnificativi pentru NPivl cauzate de organisme rezistente. Late NPivl (a avut loc după 5 zile de intubație endotraheală) la pacienții tratați anterior AB cauzate de flora multi-rezistente este de obicei: P.aeruginosa. Acinetobacter baumannii, Stenotrophomonas maltophilia. MRSA. Aceste date indică încă o dată necesitatea utilizării raționale a AB la pacienții care au suferit de ventilație mecanică, iar contul de tratament anterior cu antibiotice ca un factor de risc important NPivl cauzate de flora multi-rezistente. Aceeași nevoie este determinată prin selectarea unui mod de terapie empirica NPivl (până la obținerea rezultatelor examenului microbiologic) Preparatele cu spectru larg, care pot depasi mecanismele majore cunoscute de rezistență a florei nosocomiale pentru a îmbunătăți caracterul adecvat al ABT mod empiric.

Diferențe în flora spitalului în diferite UTI ale unui spital
Sa efectuat un studiu privind studiul diferitor agenți patogeni multiresistenți de infecții la diferite ICU dintr-un spital [44]. S-au evidențiat diferențe semnificative în sensibilitatea agenților patogeni la nivelul UTI chirurgical, traumatologic și general. Sensibilitate scăzută la Acinetobacter spp. pentru imipenem în chirurgie și sensibilitate ridicată la UTI traumatologică. Observații similare au fost făcute în UTI din alte țări [45, 46]. Aceste date confirmă necesitatea de a conveni asupra recomandărilor generale privind terapia antimicrobiană și datele locale de sensibilitate (în țară, oraș, spital și UTI). Acest lucru ajută la luarea în considerare a particularităților florei gram-negative, de exemplu frecvența de izolare a producătorilor β-lactamazei din spectrul extins printre K. pneumoniae sau E. coli; rezistente la fluorochinolonele P. aeruginosa. rezistente la carbapenemele A.baumannii. Cu o probabilitate mare de infecții cauzate de acești agenți patogeni, este necesară ajustarea regimurilor de terapie empirică.
Caracteristicile pacienților care pot influența rezistența florei la AB
În plus față de caracteristicile locale sau regionale ale florei, există multe caracteristici ale pacienților, care cresc probabilitatea de selecție a florei rezistente. Prin urmare, alegerea terapiei empirice trebuie să se bazeze pe date de monitorizare a florei locale, luând în considerare caracteristicile pacienților. Dacă există factori de risc pentru infecțiile cauzate de tulpinile de spital de S. aureus. P. aeruginosa. Acinetobacter spp. Din cauza probabilității mari de rezistență, letalitatea crește semnificativ [47-51]. Infecțiile cauzate de flora rezistente apar, de obicei, la pacienții spitalizați cu un tratament pe termen lung într-un spital, un cateterism vascular lung, utilizarea de antibiotice, prezența escare, infecții ale plagilor chirurgicale, nutriție enterală și hemodializă.
Prevalența florei nosocomiale în spital
Unele tipuri de asistență medicală, cum ar fi dializa, chimioterapie, spitale chirurgicale o zi duce la o creștere a numărului de pacienți care primesc tratament într-un mediu spitalicesc [52]. Pneumonia și infecțiile angiogenice asociate cu îngrijirea medicală, de multe ori clasificate ca infecții dobândite în comunitate, și tratat inițial cu recomandările corespunzătoare. Cu toate acestea, comunicarea frecventă între pacienți și furnizorii de servicii medicale care lucreaza in spitale, având ca rezultat faptul că flora colonizatoare la acești pacienți începe să difere de comunitate dobândită și devine mai mult ca un nosocomiale. De exemplu, MRSA, izolate de la pacientii infectati intr-un spital, ambulatoriu dramatic diferite și au diferite sensibilități la AB [19].
În plus, în ultimul deceniu a avut loc o schimbare semnificativă în rezistența florei dobândite în comunitate. Streptococcus pneumoniae este un agent cauzal major al pneumoniei comunitare, dar infecția este cauzată, și alți agenți patogeni (Chlamydia pneumoniae. Mycoplasma pneumoniae. Acinetobacter spp. MRSA, Legionella spp.), Prevalența diferă semnificativ în diferite regiuni și continuă să se schimbe [42, 53, 63, 81 ]. Răspândirea rezistenței la agenții patogeni infecții AB spital complică semnificativ tratamentul lor necesită o schimbare în conformitate cu datele microbiologice și epidemiologice [54]. Toate acestea conduc la necesitatea de a separa infecții asociate cu îngrijirea medicală, de la infecții, care sunt atribuite în mod tradițional comunitare dobandite [17, 32, 55, 56].
concluzie
Creșterea rezistenței la AB este o problemă majoră în modul de utilizare clinică eficientă a AB. Dificultatea de a menține un echilibru între nevoia de ABT adecvat și limitarea creșterii rezistenței florei dictează necesitatea de a găsi noi abordări în strategia de utilizare a antibioticelor. În ciuda faptului că noile AB-uri își extind posibilitățile de tratament, crearea lor poate să nu țină pasul cu creșterea rezistenței florei. Dacă actualii agenți patogeni gram-pozitivi au în prezent medicamente care pot rezolva toate problemele de rezistență, nu există astfel de medicamente pentru bacteriile gram-negative actuale. Aceasta subliniază încă o dată importanța gândirii strategice în aplicarea AB în condiții clinice, ceea ce poate duce la un echilibru între eficacitatea utilizării lor și limitarea creșterii rezistenței agenților patogeni.
Articole similare
Trimiteți-le prietenilor: