Cu aceasta, electronul de valență al stratului exterior al atomilor de metal alcalin este desprins ușor, transformându-i în ioni încărcați singular. Acest lucru se datorează ceva. că compușii metalelor alcaline cu alte elemente sunt construiți de tipul legăturii ionice.
Reacțiile redox ale metalelor alcaline se comportă ca agenți reducători puternici și acest lucru crește capacitatea metalului de încărcare din metal cu creșterea nucleului atomic.
Printre metale, metalele alcaline prezintă cea mai mare activitate chimică. În seria de solicitări, toate metalele alcaline sunt situate la începutul rândului. Electronul stratului electronic de electroni este singurul electron de valență, astfel că metalele alcaline în oricare dintre compuși sunt univalente. Gradul de oxidare a metalelor alcaline este de obicei +1.
Proprietățile fizice ale metalelor alcaline sunt prezentate în Tabelul. 19.
Proprietățile fizice ale metalelor alcaline. Tabelul 19
Punct de topire, ° C
Punct de fierbere, ° С
Duritate pe o scară
Reprezentanții tipici ai metalelor alcaline sunt sodiul și potasiul.
■ 26. Faceti o descriere generala a metalelor alcaline in conformitate cu urmatorul plan:
a) similaritatea și diferența în structura atomilor de metal alcalin;
b) particularitățile comportamentului metalelor alcaline în reacțiile de oxidare-reducere;
c) tipul de latură cristalină în compușii de metale alcaline;
d) caracteristicile schimbării proprietăților fizice ale metalelor în funcție de raza atomului. (Vezi răspunsul)
§ 97. Sodiu
Configurația electronică a atomului de sodiu ls 2 2s 2 2p 6 3s 1. Structura stratului său exterior:
Sodiul are loc în natură numai sub formă de săruri. Cea mai comună sare de sodiu este clorura de sodiu NaCI și KCI SILVINIT mineral · NaCl și unele sulfați, cum ar fi sarea lui Glauber Na2SO4 · 10H2O, care se produc în cantități mari în Golful Mării Garabogazkol Caspică.
Din clorură de sodiu NaCI, sodiul este preparat prin electroliza topiturii acestei sări. Instalația pentru electroliză este prezentată în Fig. 76. Electrozii sunt coborâți în sarea topită. Spațiul anodic și al catodului este separat de o diafragmă, care izolează clorul format din sodiu, astfel încât să nu apară nici o reacție inversă. Un ion de sodiu pozitiv ia un electron de la catod și este transformat într-un atom de sodiu neutru. Atomii de sodiu neutri sunt colectați pe catod sub formă de metal topit. Procesul care apare pe catod poate fi reprezentat de următoarea schemă:
Na + Na.
Deoarece electronii sunt acceptați pe catod, iar orice acceptare a electronilor de către un atom sau un ion este o reducere, ionii de sodiu de pe catod sunt restabiliți. La anod, ionii clorului deconectează electronii, adică procesul de oxidare și eliberarea liberă
gaz clor, care poate fi reprezentat prin următoarea schemă:
Cl - e - → Cl0
Sodul metalic rezultat este alb argintiu, ușor tăiat cu un cuțit. Tăietura de la sodiu, în cazul în care revizuirea imediat după tăiere are un luciu metalic strălucitor, dar rapid pătează datorită oxidării extrem de rapidă a metalului.
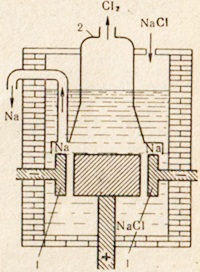
Fig. 76. Schema de instalare pentru electroliza topiturii de sare comuna.
1 - catod inelar; 2 - clopot pentru îndepărtarea clorului gazos din spațiul anodic
Dacă sodiul este oxidat într-o cantitate mică de oxigen la o temperatură de aproximativ 180 °, atunci se obține oxid de sodiu:
4Na + O2 = 2Na2O.
Când se ard în oxigen, se produce peroxid de sodiu:
2Na + O2 = Na2O2.
În acest caz, sodiul arde cu o flacără galbenă orbitoare.
Datorită rapid și ușor de sodiu oxidabilității este depozitat sub un strat de parafină sau ceară, în care ceara este preferabil deoarece kerosenul încă o anumită cantitate de aer dizolvat și oxidarea sodiu deși încet, dar încă mai are loc.
Sodiu poate da compus cu hidrogen - hidrură de NaH, în care hidrogenul prezintă o oxidare - 1. Acest compus sare asemănător, care prin natura valorii legăturii chimice și oxidare diferă de hidruri volatile ale elementelor din grupa principale grupe IV-VII.
Sodiul metalic poate reacționa nu numai cu oxigenul și hidrogenul, ci și cu multe substanțe simple și complexe. De exemplu, atunci când se mănâncă într-un mortar cu sulf, sodiul reacționează violent cu acesta, formând sulfură de sodiu:
2Na + S = Na2S
Reacția este însoțită de flare, astfel încât mortarul trebuie ținut departe de ochi și învelit cu un prosop. Pentru reacție, trebuie luate mici bucăți de sodiu.
Sodiul arde puternic în clor cu formarea de clorură de sodiu, observată în special într-un tub de clor-calciu, în care se trece un curent de clor printr-un sodiu topit și puternic încălzit:
2Na + Cl2 = 2NaCl
Sodiul reacționează nu numai cu substanțe simple, dar și cu substanțe complexe, de exemplu cu apă, înlocuind hidrogenul din acesta. deoarece este un metal foarte activ, în seria de solicitări este mult la stânga de hidrogen și deplasează ușor ultima din apă:
2Na + 2H2O = 2NaOH + H2
Este imposibil să stingeți un metal alcalin cu apă. Cel mai bine este să-l umpleți cu pudră de cenușă. În prezența sodiului, flacăra incoloră a arzătorului de gaz devine galbenă.
Metalul sodic poate fi utilizat ca un catalizator în sinteza organică, de exemplu, în producția de cauciuc sintetic din butadienă. Acesta servește ca materie primă pentru prepararea altor compuși de sodiu, de exemplu peroxid de sodiu.
■ 27. Să demonstreze, folosind reacțiile din text cu participarea sodiului metalic, că se comportă ca agent reducător. (Vezi răspunsul)
28. De ce nu pot fi depozitate sodiu în aer?
29. Studentul a pus o bucată de sodiu în soluția de sulfat de cupru, sperând să înlocuiască cuprul cu sarea. În locul unui metal roșu, a apărut un precipitat albastru gelatinos. Descrieți reacțiile care au apărut și scrieți ecuațiile lor în formele moleculare și ionice. Cum ar trebui schimbate condițiile de reacție astfel încât reacția să conducă la rezultatul dorit? Scrieți ecuațiile în forme ionice moleculare, totale și reduse.
30. 2,3 g de sodiu metalic sunt plasate într-un vas cu 45 ml apă. Care este concentrația soluției de hidroxid de sodiu formată la sfârșitul reacției.
31. Ce mijloace pot fi utilizate pentru a stinge arderea de sodiu? Dați un răspuns valid. (Vezi răspunsul)
§ 98. Compuși de oxigen ai sodiului. Soda corozivă
Compușii de oxigen ai sodiului, așa cum s-a menționat deja, sunt oxidul de sodiu Na2O și peroxidul de sodiu Na2O2.
Oxidul de sodiu Na2O nu contează. Reacționează energic cu apă, formând o sifonă caustică:
Na2O + H20 = 2NaOH
Peroxidul de sodiu Na202 este o pulbere gălbui. Se poate considera ca un fel de sare de peroxid de hidrogen, deoarece structura sa este aceeași cu cea a H2O2. Ca și peroxidul de hidrogen. peroxidul de sodiu este cel mai puternic oxidant. Atunci când acționează apa, formează peroxid de hidrogen și alcaline:
Na2O2 + H2O = H2O2 + 2NaOH
Peroxidul de hidrogen este, de asemenea, format prin acțiunea acizilor diluați pe peroxidul de sodiu:
Na2O2 + H2S04 = H202 + Na2S04
Toate proprietățile de peroxid de sodiu de mai sus permit ca acesta să fie utilizat pentru înălbirea tuturor materialelor posibile.
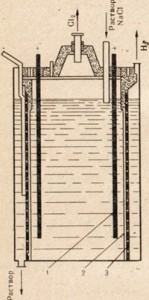
Fig. 77. Diagramă de instalare pentru electroliză a soluției de clorură de sodiu.
1 - anod; 2 - diafragmă care separă spațiul anodic și catodic; 3 -katod
Un compus foarte important de sodiu este hidroxidul de sodiu sau hidroxidul de sodiu, NaOH. Se mai numește și sodă caustică sau pur și simplu caustică.
Pentru hidroxid de sodiu se utilizează clorură de sodiu - cea mai ieftina compus natural de sodiu prin supunerea acesteia la electroliza, dar în acest caz nu este utilizat topitură, iar soluția de sare (Figura 77.). Pentru o descriere a procesului de electroliză a unei soluții de sare comuna, vezi § 33. În Fig. 77 arată că spațiul anodic și catodic este separat de o diafragmă. Acest lucru se face pentru ca produsele rezultate nu vin în contact unele cu altele, de exemplu Cl2 + 2NaOH = NaClO + NaCl + H2O.
Soda corozivă este o substanță cristalină solidă de culoare albă, perfect solubilă în apă. Când se dizolvă hidroxidul de sodiu în apă, se eliberează o cantitate mare de căldură și soluția este încălzită puternic. soda caustica trebuie depozitate în containere bine sigilate, pentru a se proteja împotriva pătrunderii vaporilor de apă sub acțiunea care poate hidratat puternic, precum dioxidul de carbon, prin acțiunea de sodă caustică, care poate transforma treptat într-un carbonat de sodiu:
2NaOH + CO2 = Na2C03 + H20.
Sodiul corrosiv este un alcalin tipic, deci măsurile de precauție atunci când lucrați cu acesta sunt aceleași ca și atunci când lucrați cu alți alcalini.
soda caustica este utilizat în multe industrii, pentru producerea de săpun exemplu curățarea uleiului de grăsimi în industria hârtiei, la fabricarea fibrelor sintetice și vopsește farmaceutice și colab. (Fig. 78).
• Scrieți în notebook zona de aplicare a sodiului caustic.
primă sare de masă de săruri de sodiu trebuie notat NaCl, care servește ca materie primă principală pentru producerea de hidroxid de sodiu și sodiu metalic (pentru detalii cu această sare cm. P. 164) soda Na2CO3 (cm. P. 278), sulfat de sodiu Na2SO4 (cm , pagina 224), azotat de sodiu NaNO3 (vezi pagina 250) și altele.
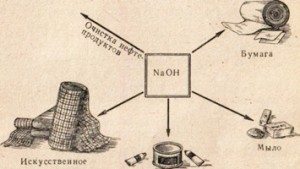
Fig. 78. Utilizarea sodei caustice
■ 32. Descrieți metoda de obținere a hidroxidului de sodiu prin electroliza sarii comestibile. (Vezi răspunsul)
33. Soda caustică poate fi obținută prin acțiunea carbonatului de sodiu cu var cald. Asigurați formă moleculară și ionică a ecuației pentru această reacție, și se calculează cât de mult sodă care conține 95% carbonat necesară pentru a obține 40 kg de hidroxid de sodiu.
34. De ce, atunci când depozitați soluția de hidroxid de sodiu în sticle cu dopuri de pământ, prizele sunt "confiscate" și nu pot fi îndepărtate? Dacă, totuși, într-o anumită perioadă de timp, țineți balonul înfundat în apă, atunci pluta se îndepărtează cu ușurință. Explicați, oferind ecuațiile de reacție, ce procese au loc în acest caz.
35. Scrieți ecuațiile reacțiilor în formele moleculare și ionice care caracterizează proprietățile sodiului caustic ca alcaline tipice.
36. Ce măsuri de precauție trebuie luate atunci când lucrați cu sodă caustică? Ce masuri de prim ajutor ar trebui sa fie furnizate cu arsuri cu soda caustica? (Vezi răspunsul)
§ 99. Potasiu
Potasiul K este, de asemenea, un metal alcalin destul de comun, care diferă de sodiu de dimensiunea razei atomice (a patra perioadă) și, prin urmare, are o activitate chimică mai mare decât sodiul. Configurația electronică a atomului de potasiu este 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1.
Structura stratului său de electroni extern
Potasiul este un metal moale tăiat cu un cuțit. Pentru a evita oxidarea, acesta, ca și sodiul, este depozitat sub un strat de kerosen.
Cu apă, potasiul reacționează și mai violent decât sodiul, cu formarea de alcalii și cu evoluția hidrogenului, care arde:
2K + 2H20 = 2KOH + H2.
Când ardeți în oxigen (se recomandă să luați chiar mai mici bucăți de metal pentru ardere decât pentru arderea sodiului), arde ca sodiul, foarte puternic cu formarea de peroxid de potasiu.
Trebuie remarcat faptul că manipularea potasiului este mult mai periculoasă decât sodiul. O explozie puternică poate apărea chiar și atunci când se taie potasiu, așa că trebuie să o faceți mai atent.
Hidroxidul de potasiu sau hidroxidul de potasiu KOH este o substanță cristalină albă. Potasiu caustic în toate privințele este similar cu sodă caustică. Ele sunt utilizate pe scară largă în industria săpunului, dar costul său este oarecum mai scump, deci nu găsește o astfel de aplicație ca NaOH.
Pot fi menționate în special săruri de potasiu, deoarece unele dintre ele sunt utilizate pe scară largă ca îngrășământ. Acestea sunt clorura de potasiu KCl, nitratul de potasiu KNO3, care este, de asemenea, un îngrășământ azotat.
■ 37. Cum se explică faptul că potasiul caustic este mai activ chimic decât sodă caustică? (Vezi răspunsul)
38. O bucată de potasiu a fost aruncată în cristal cu apă. După ce reacția s-a terminat, s-a plasat, de asemenea, un pic de hidroxid de zinc sub formă de precipitat gelatinoasă albă. Sedimentul a dispărut și când soluția a fost testată cu fenolftaleină, aceasta din urmă a fost colorată în culoarea crimsonică. Ce procese chimice au avut loc aici?
Ce substanțe sunt în soluție? Dați un răspuns valid.
39. De ce potasiul, ca toate metalele alcaline, aparține familiei s-elemente? (Vezi răspunsul)
Știi cum
Trimiteți-le prietenilor: