Toate animalele și țesuturile vegetale constau din diferiți compuși chimici: proteine, carbohidrați, grăsimi și vitamine. Și, deși toate aceste substanțe sunt necesare pentru dezvoltarea normală a organismului, cea mai mare importanță este pentru proteine. Acestea servesc acelei materii de bază, din care sunt compuse toate părțile unei singure celule și ale întregului organism. Proteinele reprezintă cel mai înalt pas în dezvoltarea materiei și cu ele se leagă inextricabil toate nenumăratele manifestări diverse ale vieții, începând cu cele mai simple funcții ale celor mai primitive creaturi și terminând cu cele mai complexe funcții ale activității umane.
Structura proteinei. Distinge între proteine simple și complexe. O proteină simplă este în prezent considerată ca un produs de policondensare a aminoacizilor, adică ca un polimer natural. Proteinele complexe constau în componente simple de proteine și non-proteine - carbohidrați, lipide, acizi nucleici și alți compuși.
Frecvente pentru toate proteinele este că macromoleculele lor sunt compuse din multe sute de legături legate între ele printr-o așa-numită legătură peptidică având o structură
Prin natura sa, fiecare legătură este reziduul unuia dintre aminoacizii. Ei formează lanțuri de polipeptide, fiecare conținând zeci sau chiar sute de reziduuri de aminoacizi diferiți. Toți ceilalți aminoacizi care alcătuiesc proteina sunt Aminoacizii în care gruparea amino NH2 este legată la același atom de carbon la care este legată gruparea carboxilică COOH. Toți a-aminoacizii (cu excepția heterociclicilor) pot fi exprimați prin formula generală
unde R este un radical hidrocarbonat.
Aminoacizii diferă unul de altul nu numai cantitativ, ci și numărul de constituenți grupurile lor NH2 și COOH, precum și prezența în structura lor a atomilor altor elemente, cum ar fi S, Br, I. În prezent, există aproximativ 26 de aminoacizi diferiți care aparțin proteină. Aproximativ jumătate din această cantitate conține numai o grupă de NH2 și COOH; ele sunt simple sau monoamino acizi. Altele conțin două grupe de COOH pe grupa amino și au proprietăți caracteristice caracteristice. Al treilea grup de aminoacizi are proprietăți de bază pronunțate, conține un grup de COOH pe două grupe amino. În plus, compoziția proteinelor include mai mulți aminoacizi ciclici, mai complexi în compoziția și structura radicalului lor R.
Pentru prima dată, schema cea mai simplă a structurii proteinei a fost dată de Fisher (1906) sub forma unui lanț polipeptidic.
Reacțiile de policondensare se desfășoară conform următoarei ecuații
Este cu ajutorul unei legături polipeptidice că are loc o polimerizare suplimentară a proteinelor de orice complexitate. Pe măsură ce crește numărul de unități de aminoacizi din moleculele de polipeptidă, crește și numărul de izomeri posibili. Astfel, limba engleză biochimistul Richard Sindj estimat că o proteină cu o greutate moleculară de 3400 (un lanț relativ scurt), fiecare moleculă care conține 288 resturi de aminoacizi, iar structura include doar 12 aminoacizi, pot avea număr complet astronomice de izomeri - 10 300. Dacă s-ar putea pentru a asambla împreună o singură moleculă din fiecare dintre izomerii posibili ai acestei proteine ipotetice, masa totală a acestor molecule ar fi de 10 277 kg. Deoarece masa Pământului este estimată a fi mult mai mică decât cifra de 10 24 kg, este destul de evident că doar câteva izomeri ale acestei proteine există în natură.
Cantitatea de proteine găsită în natură este extrem de mare. Mai multe sute de proteine diferite au fost izolate în forma pură. Si cercetarile au aratat ca numarul total de proteine care difera in proprietatile lor chimice in orice organism viu ajunge la cateva mii. Adesea, chiar și în exterior complet identice proteine din diferite surse nu întotdeauna se dovedesc a fi aceleași în compoziție și structură. Deci, toata diversitatea formelor de viata de pe planeta noastra se datoreaza existentei a cateva milioane de proteine individuale, fiecare fiind unica in felul ei.
Macromolecul proteic este un complex foarte complex. Legăturile repetate ale acestuia sunt așa-numitele micromolecule, fiecare dintre acestea cuprinzând un lanț peptidic cu 4-6 aminoacizi și formarea ciclică (inelul diketopiperazinovoyos).
Astfel, proteinele din compoziție sunt polipeptide complexe, iar în structură - polimeri înalți (policondensați înalți).
După cum au demonstrat numeroase studii, nu numai aminoacizii au propriul lor loc în lanțul polipeptid, dar lanțurile în sine în proteine sunt situate într-o ordine strict definită. Este suficient să se întrerupă dispunerea lanțurilor într-o moleculă, cum se va schimba și va muri proteina. Împreună cu legătura peptidică din molecula de proteină, există și alte tipuri de legături, în special legătura cu hidrogen. Ca rezultat, macromolecul proteinei are, în esență, caracterul unei formațiuni foarte puternice.
Numeroase studii au stabilit că toate proteinele sub formă de macromolecule pot fi împărțite în două grupuri, fibrilare și globulare.
Proteinele fibrilale sau fibroase (din fibră de fibră fibră - fibră) constau în macromolecule sub formă de filamente subțiri alungite, de obicei legate între ele. Acest grup include proteine care sunt componente ale pielii și tendoane (colagen, gelatină), păr și corn (cheratină), mușchi (miozina), si altele. In corpul uman, care operează funcționează în principal mecanice, cu toate că unele proteine fibrilare posedă activitate biologică . Deci, miozina menționată mai sus este o enzimă; scade acidul adenozin trifosforic (ATP), care are o cantitate mare de energie eliberată în timpul clivajului său.
Proteinele fibrilare la temperatura camerei sunt de obicei insolubile în apă, dar sunt capabile să se umfle în ea, ceea ce indică proprietățile lor hidrofile.
Proteinele globulare (din cuvântul latin globule - o minge) constau în macromolecule globulare, elipsoide, rareori în formă de arbore. O caracteristică caracteristică a acestor proteine este o bună solubilitate în apă, adică o hidrofilitate ridicată. Proteinele globulare se găsesc în principal în fluide biologice: în sânge, limf și protoplasm celular. Proteinele din acest grup - albuminele, precum și globulinele de proteine din ou, lapte, ser de sânge, pepsină din sucul gastric și altele - îndeplinesc funcții biologice foarte importante în organism.
Numeroase experimente au arătat că natura legăturilor în proteinele fibrilare și globulare este aceeași. Greutatea moleculară a ambelor specii proteice structurale majore este, de asemenea, aproximativ aceeași (de la 30.000 la 1.000.000 sau mai mult), dar forma este semnificativ diferită. Deci, în proteine fibrilare, lungimea macroglobulelor este de sute și mii de ori mai mare decât grosimea lor. De exemplu, o macroglobă procolagenă cu o greutate moleculară de 680.000 are o lungime de aproximativ 30 nm și o grosime de numai câteva zeci de nanometri.
globulele de proteine. Pentru stabilitatea particulelor coloidale, numai apa care creează o coajă de apă externă este importantă. Este cel care previne coliziunea și unirea macromoleculelor de proteine.
Proteinele complexe sunt compuse din proteine de simplu makroglobuly la care sunt atașate alte componente: .. Carbohidrați sau lipide, acid fosforic etc., aparțin acestui grup ca nucleoproteine și a cărui structură este deosebit de intens studiată recent. Să ne amintim că nucleoproteinele constau într-o proteină și un așa numit acid nucleic, care este un polimer constând din mononucleotide (monomeri) legate prin legăturile de ester. Fiecare din monomeri este o purină (adenină sau guanină) sau pirimidină (timină, citozină sau uracil) baze conectate prin riboză sau dizoksiribozu cu acid fosforic. O importanță deosebită este atașată încărcării electrice biologice a proteinelor, pe lângă structura lor specială, este o caracteristică a proprietăților lor. Molecula proteică conține două grupe polar: principalul - NH2 și molecula de acid - COOH, care informează macromoleculele cu proprietăți amfoterice. Proteinele nu sunt doar electroliți, ci electroliții sunt amfoliți. Aceasta înseamnă că în soluțiile apoase macromoleculele sunt capabile să disocieze ca acizi, adică cu eliminarea ionilor de hidrogen
și ca baze, adică cu eliminarea ionilor de hidroxil
Macromoleculele de proteine au o configurație spirală care poate varia în funcție de semnul încărcării lor. Astfel, în starea neutră a proteinei, ionii încărcați opuși NH3 + și COO au o atracție puternică unul cu celălalt și astfel provoacă scurtarea filamentului proteic și chiar răsucirea acestuia sub forma unei spirale:
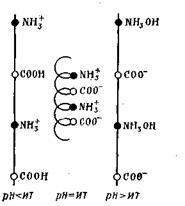
În mediu acid și alcalin apare repulzia grupurilor individuale și lanțul este întins ca un întreg, adică în spirală.
Astfel, sarcina proteinei depinde de raportul grupelor sale carboxil și aminice în molecule și de pH-ul mediului. Valoarea pH a soluției proteice, la care proteina devine neutră din punct de vedere electric, se numește punctul izoelectric al proteinei. Fiecare proteină are o valoare a pH-ului la care este în stare izoelectrică (Tabelul 6.5).
Tabelul 6.5 Experiența arată că în stare izoelectrică, vâscozitatea proteinelor este cea mai mică. Acest lucru se datorează modificării formei macromoleculelor, deoarece macromoleculele în starea nefolosită conferă o mai mare vâscozitate soluțiilor decât macromoleculele înfășurate într-o spirală sau într-o încurcătură.
Determinarea experimentală a punctului izoelectric al soluțiilor proteice, precum și determinarea stării izoelectrice a solurilor lyofobe pot fi efectuate direct sau indirect.
Metodele directe sunt reduse la observarea comportamentului particulelor într-un câmp electric în timpul electroforezei. Proteina investigată este supusă la electroforeză în soluții tampon cu valori diferite ale pH-ului. Într-o soluție tampon cu un pH egal cu punctul izoelectric al proteinei, acesta din urmă este neutru din punct de vedere electric și nu se mișcă în câmpul electric. Aceste observații se efectuează fie macroscopic în dispozitive electroforetice speciale, fie microscopic într-o cuvă a unui ultramicroscop. Pe lângă metodele directe de observare a stării izoelectrice a proteinelor, există metode indirecte care reduc la respectarea maximului sau minimului unei anumite proprietăți fizice care variază odată cu modificarea potențialului zeta al soluției de testat. Toate aceste metode sunt descrise în detaliu în manualele corespunzătoare.
Articole similare
Trimiteți-le prietenilor: