Esența hidrolizei este redusă la interacțiunea chimică de schimb a cationilor sau a anionilor sării cu moleculele de apă. Ca urmare a acestei interacțiuni, se formează un compus malodizocompounding (electrolit slab). Un exces de ioni H + sau OH - liberi apare în soluția apoasă a sării. iar soluția de sare devine acidă sau, respectiv, alcalină.
2. Săruri formate de un acid puternic și o bază slabă.
Luați în considerare hidroliza clorurii de amoniu NH4CI.
Într-o soluție apoasă de sare au loc două procese:
1) disocierea nesemnificativă reversibilă a moleculelor de apă (un electrolit amfoteric foarte slab), care poate fi simplificată prin ecuația:
2) disocierea completă a sării (electrolit puternic):
Astfel, ionii format OH - NH4 + și interacționează unele cu altele pentru a obține NH3 · H2O (electrolit slab), în timp ce ionii de H + rămân în soluție, determinând astfel mediul acid.
Ecuația ionică totală de hidroliză:
Procesul este reversibil, echilibrul chimic este mutat spre formarea de materii prime, deoarece H20 este un electrolit mult mai slab decât amoniacul NH3 · H2O.
Ecuația redusă de hidroliză ionică:
Ecuația arată că:
1) în soluție există ioni de hidrogen liber H +. și concentrația lor este mai mare decât în apa pură, deci soluția de sare are un mediu acid (pH <7);
2) cationii de amoniu NH4 + participă la reacție cu apă; în acest caz se spune că hidroliza are loc de-a lungul cationului.
Reacția cu apă poate participa și se înmulțește cationi încărcate: M 2+ încărcat dublu (de exemplu, Ni 2+, Cu 2+ Zn 2+ ..), altele decât cationii metalelor alcalino-pamantoase, triply M 3+ (de exemplu, Fe 3 +, Al 3+ , Cr3 +).
Luați în considerare hidroliza azotatului de nichel Ni (NO3) 2.
Există hidroliza sarii peste cationul Ni 2+.
Ecuația ionică totală de hidroliză:
Ecuația ionică redusă:
Produsele de hidroliză sunt sarea de bază a NiOHNO3 și a acidului azotic HNO3.
Soluția apoasă de acid nitrat de nichel (pH <7), потому что в растворе увеличивается концентрация ионов Н + .
Hidroliza sarii NiOHNO3 se desfasoara intr-o masura mult mai mica si poate fi neglijata. În acest fel:
1) asupra cationului sarii, de regulă, hidrolizat reversibil;
2) echilibrul chimic al reacțiilor este puternic deplasat spre stânga;
3) reacția mediului în soluții de astfel de săruri este acidă (pH <7);
4) când se hidrolizează săruri formate din baze slabe multi-acizi, se obțin săruri bazice.
3. Săruri formate dintr-o bază slabă și un acid slab.
Astfel de săruri sunt hidrolizate atât prin cation, cât și prin anion.
NU UITA. Posibilitatea și natura cursului de hidroliză este determinată de natura bazei și a acidului din care se formează sarea.
Cationul slab de bază leagă ionii OH de moleculele de apă, formând o bază slabă; anionul slab acid leagă ionii de H + de moleculele de apă pentru a forma un acid slab. Reacția soluțiilor acestor săruri poate fi neutră, slab acidă sau ușor alcalină. Aceasta depinde de constantele de disociere a doi electroliți slabi, acizi și baze care se formează ca urmare a hidrolizei.
De exemplu, luați în considerare hidroliza a două săruri: acetat de amoniu NH4CH3COO și formiat de amoniu NH4 HCCO:
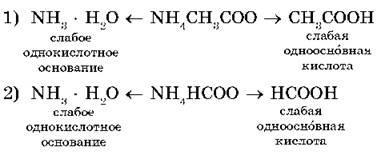
Soluțiile apoase ale acestor săruri baza slabă cationi NH4 + reacționează cu ioni de hidroxid OH - (reamintim că apa disociază) și anioni slab kislotCH3 COO - și HCOO- - interacționează cu cationii de H + pentru a forma molecule de acizi slabi - acetic CH3COOH și acid formic HCOOH.
Să notăm ecuațiile de hidroliză ionică:
În aceste cazuri, hidroliza este de asemenea reversibilă, dar echilibrul este mutat spre formarea produselor de hidroliză - doi electroliți slabi.
În primul caz, mediul de soluție este neutru (pH = 7), deoarece CD (CH3COOH) = KD (NH3 · H2O) = 1,8 · 10-5. În cel de-al doilea caz, mediul de soluție va fi ușor acid (pH <7), т. к. КД (НСООН) = 2,1 · 10 -4 и KД (NH3 · Н2 О) <КД (НСООН), где КД — константа диссоциации.
Hidroliza celor mai multe săruri este un proces reversibil. În starea de echilibru chimic, numai o parte din sare este hidrolizată. Cu toate acestea, unele săruri sunt complet descompuse de apă, adică hidroliza lor este un proces ireversibil.
Al2 S3 aluminiu sulfurat în apă este supus hidrolizei ireversibilă, adică să apară când hidroliza cation ioni H + se leagă la format prin hidroliza anion ionilor OH .. -. Aceasta îmbunătățește hidroliza și conduce la formarea de hidroxid de aluminiu insolubil și hidrogen sulfurat gazos:
Prin urmare, sulfura de aluminiu Al2S3 nu poate fi obținută prin reacția de schimb între soluțiile apoase ale a două săruri, de exemplu, clorura de aluminiu AlCl3 și sulfura de sodiu Na2S.
Ca urmare a hidrolizei, atât prin cation, cât și prin anion:
1) dacă sărurile sunt hidrolizate atât pe cation, cât și pe anion, este reversibilă, echilibrul chimic în reacțiile de hidroliză este deplasat spre dreapta; reacția mediului este fie neutră, fie slab acidă sau ușor alcalină, în funcție de raportul dintre constantele de disociere ale bazei și acidul format;
2) sărurile pot hidroliza atât asupra cationului, cât și anionului ireversibil dacă cel puțin unul dintre produsele de hidroliză părăsește sfera de reacție.
Articole similare
-
Tratamentul cu sare de durere de cap, nas curbat, durere în gât și alte afecțiuni
-
Masca pentru corp "sare de mare si miere" pentru pierderea in greutate
Trimiteți-le prietenilor: