Structura și proprietățile atomilor. În continuare, după reprezentativ de azot al grupului principal V a sistemului periodic - atomi de fosfor cu elemente metaloid fosfor R. comparativ cu atomii de azot au o rază mai mare, electronegativitate valoare minimă și proprietăți de reducere, prin urmare, mai pronunțate. Compușii având un grad de oxidare a atomului de fosfor -3 mai rar decât azotul (numai fosfidah - compuși ai fosforului cu metale, de exemplu Sa3R2, Na3R). Mai des, fosforul prezintă în compuși o stare de oxidare de +5. Dar compusul acesteia cu hidrogen - PH3 fosfină - cazul rar în care o legătură covalentă între atomii diferitelor elemente din nepolar deoarece electronegativitatea de fosfor și hidrogen au aproape aceleași valori.
Fosforul este o substanță simplă. Elementul chimic fosfor formează mai multe modificări alotropice. Dintre acestea, știți deja două substanțe simple: fosfor alb și fosfor roșu.
Fosforul alb are o latură de cristal moleculară formată din molecule P4. Insolubil în apă, ușor solubil în disulfură de carbon. Este ușor de oxidat în aer și chiar se aprinde într-o stare pulbere.
Fosforul alb este foarte toxic. O proprietate specială a acesteia este abilitatea de a străluci în întuneric datorită oxidării sale. Păstrați-l sub apă.
Fosforul roșu este o pulbere de culoare închisă închisă. Nu se dizolvă nici în apă, nici în disulfură de carbon. În aer se oxidează încet și nu se autoinfectează. Nu este clară și nu strălucește în întuneric.
La încălzirea fosforului roșu într-un tub de testare, închis cu un tampon de bumbac, se transformă în fosfor alb (perechi concentrate), iar în cazul fosforului alb trage tampon se va aprinde în aer (fig. 35). Această experiență arată inflamabilitatea fosforului alb.
Proprietățile chimice ale fosforului roșu și alb sunt apropiate, dar fosforul alb este mai activ chimic. Deci, ambele, așa cum se potrivește cu nemetalele, interacționează cu metalele. formarea fosfurilor:
Fosforul alb se aprinde spontan în aer, iar arsurile roșii se aprind. În ambele cazuri se formează oxid de fosfor, care este eliberat ca un fum alb gros:
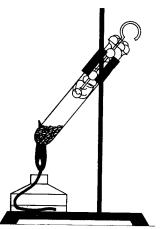
Fig. 35. Experiență care ilustrează tranziția fosforului roșu la alb
Cu hidrogen, fosforul nu reacționează direct, fosfina PH3 poate fi obținută indirect, de exemplu de la fosfizi:
Ca3P2 + 6HCI = 3CaCI2 + 2PH3
Fosfina este un gaz foarte toxic, cu un miros neplăcut. Este ușor de aprins în aer. Această proprietate a fosfinei și explică aspectul luminilor rătăcite ale mlaștinilor.
Compuși ai fosforului. Atunci când se formează fosfină sau fosfor, după cum deja știți, oxidul de fosfor P205 - pulbere higroscopică albă. Acesta este un oxid tipic acid. care posedă toate proprietățile oxizilor acide.
Acidul fosforic H3P04 corespunde oxidului de fosfor. Este o substanță transparentă cristalină solidă, ușor solubilă în apă în orice proporție. Ca acid tribazic, H3P04 formează trei serii de săruri:
săruri medii sau fosfați, de exemplu Ca3 (PO4) 2, care sunt insolubili în apă, cu excepția fosfaților de metale alcaline;
sărurile acide sunt fosfații dihidrogenici, de exemplu Ca (H2P04) 2, majoritatea fiind ușor solubili în apă;
sare acidă - .. hydrogenphosphates astfel SaNR04, care sunt greu solubile în apă (cu excepția fosfați de sodiu, potasiu și săruri de amoniu), adică intermediari între fosfați și fosfați acizi de solubilitate.
În natură, fosforul în forma sa liberă nu este găsit - numai sub formă de compuși. Principalii compuși naturali ai fosforului sunt mineralele fosforite și apatite. Masa lor principală este fosfatul de calciu Ca3 (PO4) 2, din care fosforul este produs în industrie.
Semnificația biologică a fosforului. Fosforul este o parte constantă a țesuturilor organismelor umane, animale și de plante. În corpul uman, cea mai mare parte a fosforului este asociată cu calciu. Pentru a construi un schelet, un copil are nevoie de atat de mult fosfor ca si calciu. În plus față de oase, fosforul se găsește în țesuturi nervoase și cerebrale, sânge, lapte. În plante, ca și în animale. fosforul face parte din proteine.
Deoarece fosfor ingerate cu alimente, în principal, din ouă, carne, lapte și pâine, este construit ATP - adenozintrifosfat care servește drept colector și transportatorul de energie, precum și acizi nucleici - ARN și ADN care transportă proprietăților de transmisie ereditare ale organismului. Cel mai intens ATP este consumat în organele active ale corpului: în ficat. mușchi, creier. Nu e de mirare că faimosul mineralogist, unul dintre fondatorii științei geochimiei, Academicianul AE Fersman a numit fosforul "un element al vieții și al gândirii".
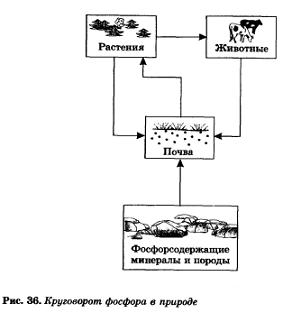
După cum sa indicat, fosforul există în natură sub formă de compuși conținute în sol (sau dizolvate în apele naturale). Din sol, fosforul este extras de plante, iar animalele primesc fosfor cu alimente vegetale. După moartea organismelor vegetale și animale, fosforul trece din nou în sol. Acesta este modul în care fosforul circulă în natură (Figura 36).
Utilizarea fosforului și a compușilor săi. fosfor rosu este utilizat pentru fabricarea de chibrituri, acidul fosforic, care, la rândul său, este producerea de îngrășăminte fosfat și suplimente nutritive pentru animale. În plus, fosforul este utilizat pentru a produce pesticide (amintiți-vă baloanele cu diclorvos, clorofos etc.).
Descoperirea fosforului. Fosforul a fost descoperit de alchimistul german G. Brand în 1669 și a primit numele său pentru capacitatea sa de a străluci în întuneric (fosfor grecesc - purtând lumina).
1. Alotropia fosforului: fosfor alb, fosfor roșu.
2. Proprietățile fosforului: formarea fosfurilor, fosfinei, oxidului de fosfor (V).
3. Acid fosforic și trei serii ale sărurilor sale: fosfați, hidrofosfați și fosfați dihidrogenici.
4. Valoarea biologică a fosforului (fosfat de calciu, ATP, ADN și ARN).
5. Utilizarea fosforului și a compușilor săi.
Scrieți formulele pentru cele trei tipuri de săruri de sodiu și acid fosforic, numiți-le și scrieți ecuațiile disocierii lor.
Scrieți ecuațiile reacțiilor, cu care puteți face următoarele transformări:
P -> Mg3P2 -> PH3 -> P205 -> H3P04 -> Ca3 (PO4) 2
Folosind metoda echilibrului electronic, alcătuiți ecuația procesului de reacție conform schemei:
P + HNO3 + H20 -> H3P04 + NU
În industrie, fosforul se obține prin calcinarea unui amestec de fosfat de calciu cu nisip și cocs în conformitate cu ecuația:
Ca3 (PO4) 2 + 3Si02 + 5C = 3CaSi03 + 2P + 5COt
Cati kilograme de acid fosforic 80% pot fi obtinute din 31 kg de fosfor continand 5% impuritati?
În 980 g de soluție 5% de acid fosforic s-au dizolvat 152 g de oxid de fosfor (Y). Care a fost fracția de masă a acidului fosforic în soluția rezultată?
“. Da! Era un câine, uriaș, negru ca pământ. Dar niciunul dintre noi, muritori, nu a văzut un astfel de câine. Din gura ei deschisă o flacără izbucni, ochii îi străluceau scânteiere, un foc în flăcări strălucea în față și se încleșta. Nimeni în a cărui creier inflamat nu putea avea o viziune mai teribilă, mai dezgustătoare decât această creatură plină de ură, a sărit de la noi din ceață. Un caine groaznic, dimensiunea unei tinere leoaice. Gura lui uriașă încă strălucea cu o flacără albăstrui, ochii sălbatici adânc înfipți în jurul cercurilor de foc. Am atins acest cap strălucitor, și mi-am luat mâna și am văzut că degetele mele erau de asemenea aprinse în întuneric. - Fosfor, am spus.
În acest pasaj din celebrul "Câini din Baskerville", A. Conan-Doyle a făcut o greșeală chimică semnificativă. Nume-l.
Dacă aveți corecții sau sugestii pentru această lecție, scrieți-ne.
Dacă doriți să vedeți alte ajustări și dorințe pentru lecții, consultați aici - Forumul educațional.
Articole similare
Trimiteți-le prietenilor: