Toată spațiul din jurul nostru este important. Materialul, în conformitate cu cunoașterea modernă a structurii atomului, poate fi în una din cele patru stări: starea solidă, lichidă, gazoasă și plasmă. Cu alte cuvinte, materia este tot ceea ce ne înconjoară cu copaci, aer, apă, pământ etc. Materia, la rândul său, constă din atomi și molecule, precum și compuși ai diferitelor elemente.
Elementul este un bloc condiționat în generarea materiei. Adică elementul este cea mai elementară parte a unei substanțe chimice. Știința modernă este conștientă de cele 121 de elemente, deși doar 94 sunt cunoscute în natură (restul sunt create artificial).
Un compus este o combinație de două sau mai multe elemente chimice care pot fi separate chimic. Cel mai simplu exemplu aici este apa obișnuită, care, după cum știm din cursul chimiei școlare, constă din oxigen și hidrogen.
O moleculă este un fel de combinație de doi sau mai mulți atomi. Moleculele stochează toate proprietățile conexiunii.
Atom este cea mai mică particulă elementară cunoscută până în prezent, păstrând toate proprietățile elementului din care face parte.
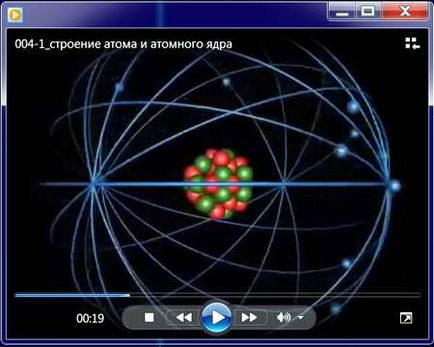
Structura electronică a atomului
Atomii constau din părți mai mici, numite electroni. Se rotesc în jurul nucleului central al unui atom format din unul sau mai multe protoni și neutroni, în orbite concentrice. Electronii sunt considerați încărcați negativ, protoni pozitivi și neutroni - particule elementare neutre.
Fiecare orbită este denumită cochilie. Ele sunt umplute succesiv din nucleu de electroni.
Acum, să încercăm să înțelegem structura coajelor de electroni ale atomilor. Ceașul exterior a fost numit valență, iar numărul de electroni care se rotesc pe el se numește valență. Mai departe de nucleu, învelișul de valență, cu cât forța de atracție este mai mică, fiecare electron de valență trece de la nucleu. Astfel, un atom poate atașa electronii cu condiția ca coaja de valență să nu fie umplută și să fie departe de nucleu sau, în unele cazuri, chiar să le piardă. Electronii din cochilia de valență sunt capabili să primească energie. Dacă electronii care sunt acolo primesc nivelul necesar de încărcare de la orice forțe externe, ei pot să se desprindă de ea și să părăsească sistemul, adică să devină electroni liberi.
Acestea din urmă pot să se miște în mod arbitrar de la un atom la altul. Aceste materiale care au un număr mare de electroni liberi sunt altfel numiți dirijori.
Dielectrică, acesta este opusul conductorilor. Acestea intervin cu fluxul de curent electric. Dielectricile sunt destul de stabile și constante, deoarece electronii de valență ai unor sisteme umple vasele altora, care le unește. Acest proces interferează cu formarea electronilor liberi. Semiconductorii au ocupat poziția intermediară între dielectrici și conductori. dar le vom aminti în cursul fundamentelor electronicii.
Structura electronică a atomului și proprietățile sale
Deci, să rezumăm atomul. care are același număr de electroni negativi și particule elementare încărcate pozitiv de protoni, este neutru din punct de vedere electric.
Un atom care a atașat unul sau mai mulți electroni se transformă într-un ion încărcat negativ și se numește ion negativ. Dacă din contră, pierde unul sau mai mulți electroni, se transformă într-un ion încărcat pozitiv.

Articole similare
Trimiteți-le prietenilor: