Legătura sigma (σ) este o legătură formată de nori de electroni de-a lungul unei linii care leagă nucleele de atomi. Legăturile simple sunt întotdeauna obligațiuni.
Legătura p (π) este o legătură formată prin suprapunerea norii electronilor de fiecare parte a unei linii care leagă nucleele atomilor.
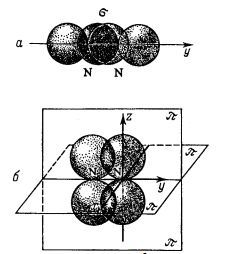
Configurația de electroni având un atom de azot al 1s ^ 2; 2s ^ 2 ^ 3; 2p are trei orbitali p dispuse în direcții reciproc perpendiculare - pe axele x, y și z. Să presupunem că doi atomi de azot sunt apropiate unul de altul, se deplasează de-a lungul axei Y. Apoi, când o convergență suficientă a două suprapunere-2 PY orbital, formând un nor de electroni comun care este situat de-a lungul axei care leagă nucleele atomice (Fig.). Legăturii covalente formate prin norul de electroni de cea mai mare densitate pe linia care leagă centrele atomilor se numește o legătură sigma.
Să ne gândim la ceea ce se întâmplă cu electronii nețărbiți ai atomilor de azot care se apropie unul de celălalt. În Fig. sunt prezentate funcțiile de undă ale electronilor 2pz ai atomilor de azot. Orbalii lor se suprapun. Dar spre deosebire de suprapunerea directă a orbitalilor în formarea legăturii σ, apare aici o suprapunere laterală. Ca rezultat, se formează două regiuni de suprapunere, care sunt dispuse pe ambele părți ale liniei care unește nucleele atomilor, cu planul care trece prin axa z și y este planul de simetrie al regiunilor de suprapunere. Legătura covalentă formată de electroni ale căror orbite dau cea mai mare suprapunere pe fiecare parte a liniei care leagă centrele de atomi este numită cuplajul PI.
Este evident că doi electroni de 2 pixeli de atomi de azot formează o a doua legătură π, care este situată în apropierea planului care trece prin axele y și x. Astfel, există trei legături chimice în molecula de azot, dar aceste legături nu sunt aceleași: una dintre ele este δεσμός σ, iar celelalte două sunt legături π.
Trimiteți-le prietenilor: