Tema - 7: Soluții ca sisteme fizice și chimice. Soluții saturate și nesaturate. Concentrația substanțelor în soluție.
· Teoria disocierii electrolitice Arrhenius.
· Hidroliza sărurilor și electroliza topiturilor și a soluțiilor de săruri.
· Înregistrați ecuațiile reacției de schimb ionic
· Determinați aciditatea soluțiilor cu indicatori bazați pe acid.
· Compune ecuațiile ionice complete și reduse de hidroliză a sării.
· Preziceți reacția mediului în soluțiile de sare.
· Rezolva problemele pentru concentrarea soluțiilor.
7.1. Solubilitatea substanțelor.
Atunci când solidele se dizolvă în apă, ele devin mai întâi zdrobite la molecule sau ioni și apoi difuzia acestor particule prin volumul soluției.
Procesul de dizolvare a unui solid poate fi accelerat prin măcinarea și transformarea acestuia într-o pulbere. Difuzia care apare în soluție este, de obicei, accelerată prin amestecarea soluției (Figura 15). Dacă solut pus pe o suprafață de apă, deoarece soluția are o densitate mare, acesta va curge în jos la partea de jos a containerului, iar în locul său va primi o nouă porție de apă.
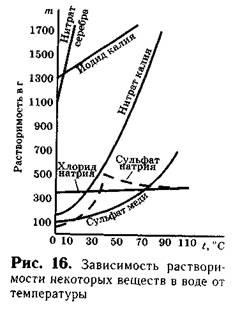
Se știe că solubilitatea majorității substanțelor nu este limitată. Deci, în condiții normale, 100 g de apă se dizolvă aproximativ 36 g de sare de masă, 40 g de azotat de potasiu, 200 g de zahăr și altele asemenea. D. Dacă suntem solubili, de exemplu, 36 g de clorură de sodiu în 100 g de apă la 20 ° C, apoi mai multă sare din această soluție nu se va dizolva.
O soluție în care substanța nu se dizolvă la o anumită temperatură se numește saturație. Sarea insolubilă va fi pe fundul unui vas cu o soluție saturată.
O soluție în care substanța este încă dizolvată la o anumită temperatură se numește nesaturată.
Masa substanței, care formează o soluție saturată în 100 g de solvent la o anumită temperatură, se numește solubilitatea acestei substanțe sau a coeficientului de solubilitate.
Solubilitatea substanțelor este foarte diferită. Solubilitatea anumitor substanțe este foarte mică. Astfel, solubilitatea BaS04 sulfat de bariu în 100 g de apă egală cu 0,00023 g de clorură de argint și 0,00015 g de astfel de substanțe spun că acestea sunt practic insolubile. Dacă solubilitatea substanței mai mare de 0,1 g și mai puțin de 1 g în 100 g de apă, ceva despre o astfel de substanță se spune că au puțin sau puțin solubilă. Astfel de substanțe includ sulfatul de calciu CaS04, Mg3 fosfat de magneziu (P04) 2 și altele. Compușii a căror solubilitate mai mare de 1 g în 100 g de apă, este considerată solubilă. Astfel, solubilitatea clorurii de sodiu la 20 ° C - aproximativ 40, solubilitatea iodură de potasiu, la aceeași temperatură egală cu 144 g Aceste substanțe sunt solubile.
Când soluțiile sunt încălzite, solubilitatea majorității solide crește (Figura 16).
Unele lichide se dizolvă, de asemenea, în apă, de exemplu, alcool, glicerină. Alte lichide, cum ar fi benzina, uleiurile, practic nu se dizolvă în apă.
De asemenea, gazele se dizolvă în apă. Solubilitatea gazelor în apă este ușor de detectat dacă se toarnă într-un pahar de apă rece și se pune într-un loc cald. După un timp, bulele de gaz vor apărea pe pereții paharului.
Apa carbonată este o soluție de dioxid de carbon în apă. Gazul din această apă este dizolvat la presiune ridicată. Astfel, spre deosebire de solide, solubilitatea gazelor scade odată cu creșterea temperaturii, dar crește odată cu creșterea presiunii.
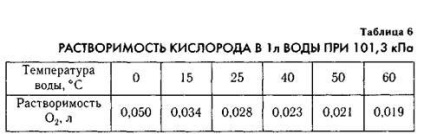
De mare importanță este solubilitatea oxigenului în apă, dezvoltarea și menținerea vieții în rezervoare depind de aceasta.
Din tabel. 6 se poate observa că mai mult oxigen este dizolvat în apa rece. De aceea, în apele reci ale oceanului, viața subacvatică este mai bogată decât în apele calde. În apele reci, peștii sunt mai abundenți. Prin urmare, principalele zone de pescuit sunt situate în ape reci.
1. Substanțele care se află într-o stare solidă, lichidă și gazoasă se dizolvă în apă, formând soluții.
2. Pe măsură ce crește temperatura, solubilitatea solidelor tinde să crească, iar gazele să scadă.
7.2. Concentrația soluțiilor
O caracteristică importantă a soluțiilor este concentrarea. Prin concentrare se înțelege raportul dintre masa sau cantitatea de substanță dizolvată și volumul soluției. De obicei, concentrația molară este utilizată în chimie.
Concentrația molară a soluției este raportul dintre cantitatea de substanță dizolvată și volumul acestei soluții:
CA = n__ (mol / l)
Cunoscând cantitatea de substanță dizolvată într-un volum al soluției, este posibil să se determine concentrația molară a acesteia.
Astfel, concentrația și fracția de masă a substanței în soluție sunt concepte diferite. Concentrația caracterizează soluția, fracția de masă este substanța dizolvată.

2. Se calculează concentrația molară a soluției, în 300 ml din care se dizolvă 0,5 moli de substanță.
3. Concentrația molară a soluției este de 1,5 mol / l. Cât din substanța dizolvată este conținută în 200 ml de soluție?
4. Se determină masa substanței (Mg = 111 g / mol) conținută în 200 ml de soluție 0,5 M.
5. Determinați concentrația molară a soluției de 20% a substanței (Mg-40 g / mol), a cărei densitate p = 1,11 g / ml.
7.3. Disocierea electrolitică a substanțelor
Soluțiile apoase ale unor substanțe conduc un curent electric. Este posibil să se concluzioneze că acest lucru se datorează unor particularități ale structurii lor?
Luați trei substanțe - zahăr, sare de masă și apă distilată. Folosind instalația prezentată în Fig. 17, să le verificăm conductivitatea electrică. Experimentele arată că niciuna dintre aceste substanțe nu conduce curent. Apoi preparăm soluții de zahăr și sare de masă în apă și determinăm conductivitatea electrică a soluțiilor apoase de substanțe. Soluția de zahăr nu conduce un curent electric, dar soluția de sare de masă conduce.
Experimente similare privind determinarea conductivității electrice a mai multor substanțe, a soluțiilor și a topiturilor lor au făcut posibilă divizarea substanțelor în două grupe mari - electroliți și non-electroliți.
Substanțele, soluțiile sau topiturile conduc curent electric, numite electroliți. Substanțele, soluțiile și topiturile care nu conduc un curent electric sunt numite non-electroliți.
Electroliții sunt săruri, alcalii și acizi - substanțe cu legături covalente ionice sau polare. Electroliți - zahăr, alcool, azot. oxigen și alte substanțe având legături covalent nonpolar sau polaritate scăzută.
Dacă o soluție a oricărei substanțe conduce un curent electric, aceasta înseamnă că există particule încărcate în soluție care se pot mișca. Fără aceste condiții, conductivitatea electrică este imposibilă. Reamintim: metalele conduc energia electrică bine, deoarece au electroni liberi.
Compușii ionici (săruri, alcalii) constau în ioni, dar în formă solidă curentul nu se realizează, deoarece ionii nu se pot mișca liber. De ce, în soluțiile de electroliți, particulele încărcate sunt capabile să se miște? Poate motivul este structura moleculelor de apă?
Atomii de oxigen și de hidrogen din molecula de apă sunt conectați printr-o legătură covalentă polară, perechile de electroni comune sunt deplasate către cel mai oxigenat atom de oxigen. Prin urmare, se formează o sarcină negativă parțială (8-) și o sarcină parțială pozitivă (# 948; +) asupra atomilor de hidrogen. Astfel, există două poli în molecula de apă, adică fiecare moleculă este un dipol.
Moleculele de apă care sunt în mișcare termică constantă au o energie considerabilă. Când cufundat în apă ion cristalul de clorură de sodiu, moleculele de apă sunt atrase de capetele pozitive ale dipolilor ioni negativi și negativi - ioni pozitivi. Energia cinetică a moleculelor de apă este suficientă pentru a distruge cristalul sării de masă în ioni individuali de Na și Cl
Ionii de sodiu formați și ionii de clorură se mișcă liber
în soluție, sunt purtători de taxe. Distrugerea cristalelor de sare de masă are loc și atunci când sunt încălzite până la punctul de topire. Astfel, particulele încărcate apar, de asemenea, în topitură, capabile să se miște liber.
Procesul simplificat de disociere electrolitică poate fi scris sub forma ecuației:
Toate sărurile disociază în ioni metalici și ioni ai reziduurilor acide, de exemplu:
Alcalinele disociază în ioni metalici și ioni de hidroxid, de exemplu
Sumele sarcinilor ionilor pozitivi și negativi formați în timpul disocierii electrolitice a materiei sunt egale în valoare absolută.
Disocierea electrolitică a substanțelor cu o legătură polară covalentă va fi luată în considerare cu exemplul de acid clorhidric.
Atunci când moleculele de hidrogen ale acidului clorhidric intră în apă, ele sunt înconjurate de dipoli de apă. Sub influența moleculelor de apă în legătură fiecare moleculă de acid clorhidric gazos, chiar mai polarizată, perechea de electroni de ansamblu este deplasat în întregime la un atom de clor și hidrogen se formează ioni și clor. substanțe ecuație de disociere cu legături covalente polare este înregistrată precum și a substanțelor cu legături ionice.
Studiul proprietăților substanțelor este una dintre cele mai importante modalități de înțelegere a structurii lor. Astfel, în funcție de capacitatea unei substanțe de a conduce sau de a conduce un curent electric în soluții sau topiri, este posibil să se precizeze natura legăturii chimice în ea. Electroliții sunt caracterizați printr-o legătură puternică polară ionică sau covalentă. Procesul de descompunere a unui electrolit în ioni se numește disociere electrolitică; în soluție, se datorează interacțiunii materiei cu dipolii de apă și în topitură - prin încălzire.
3. Scrieți ecuațiile de disociere electrolitică a următoarelor substanțe: a) KBr; b) NaF; c) Lil; d) HI.
4. Scrieți și citiți ecuațiile de disociere electrolitică a acizilor: a) HBr; b) H, S03; c) H3P04; d) HMn04.
5. Compuneți și citiți ecuațiile de disociere electrolitică a alcalinilor: a) KOH: b) Ba (OH) 2; c) LiOH; d) Sr (OH) 2.
6. Compuneți și citiți ecuațiile de disociere electrolitică a sărurilor: a) MgCl2; b) Na3PO4; c) CuS04; d) Fe (N03) 3.
7.4. Proprietățile ionilor
Proprietățile atomilor și ionilor formate din ele diferă, datorită structurii lor diferite. Pentru a vedea acest lucru, să luăm în considerare atomii și ionii de sodiu și clor.
Ioniile se formează ca urmare a restructurării cojilor de electroni ai atomilor de sodiu și clor. Carcasa electronică a ionului de sodiu este similară cu carcasa atomului de neon și a ionului de clor în cochilie
carcasa electronică a atomului de argon (Figura 22). Prin urmare, proprietățile ionilor de sodiu și ionilor de clor sunt complet diferite de cele ale atomilor de sodiu și clor. Metalul de sodiu constă din atomi și ioni de sodiu și clor gazos - din molecule, care constau din doi atomi de clor. Se știe că sodiul este un metal activ, iar clorul este un metal activ. Aceste substanțe sunt semnificativ diferite de clorura de sodiu (sare de masă), care constă în ioni de sodiu și ioni de clor. Astfel, clorura de ioni de clor și sodiu. Astfel, clorura de sodiu, spre deosebire de clor, este incoloră, inodoră și netoxică. Spre deosebire de sodiu, clorura de sodiu nu reacționează cu apa și nu înlocuiește hidrogenul din apă. Dacă sodiul metalic și clorul gazos sunt periculoase pentru corpul uman, atunci ionii Na + și SG sunt necesari pentru funcționarea normală. Prin urmare, sarea de masă se adaugă la alimente.
Ionii de sodiu și ionii de clor în soluție sunt incolori. Cu toate acestea, există și ioni colorați. Astfel, ionii de Cu2 + în soluție au o culoare albastră, iar ionii reziduului acid din MnO4-acid manganic sunt purpuriu-violet. (Sarea de potasiu a acestui acid - permanganatul de potasiu KMn04 este utilizat pe scară largă în medicină sub denumirea de "mangan". Soluția de permanganat de potasiu este colorată datorită ionilor Mn04.)
Substanțele care conțin ioni colorați pot fi folosite pentru a demonstra că ionii sunt particule încărcate. Vom realiza un astfel de experiment. Umidem hârtia de filtru cu o soluție de azotat de potasiu, care, după cum se știe, conduce curent electric. Conectăm hârtia de filtru umezită cu soluția de electrolit la sursa de curent continuu și așezați pe ea cristale de clorură de CuC12 de cupru (II) (figura 23). Ionii de cupru sunt colorați, iar ionii de potasiu, ionii de clorură și nitrați sunt incolori. După un timp, limbile colorate vor fi extrase din cristalele de sare către electrodul încărcat negativ. Aceasta înseamnă că ionii de cupru din Cu sunt deplasați spre electrodul încărcat negativ, catodul. Poți
Se sugerează ca ionii de potasiu K să se deplaseze în aceeași direcție, iar ionii de clor și ionii de azot NO3 se deplasează spre anodul electrode încărcat pozitiv.
Ioni care se deplasează în câmp electric la catod sunt numiți cationi.
Ionii care se deplasează în câmpul electric la anod se numesc anioni.
Anionii sunt ion OH OH, precum și ionii reziduurilor acide N03-, SO42-, Cl-, etc.
După cum am văzut, ionii sunt încărcați cu particule și, prin urmare, interacționează unul cu altul prin forțe Coulomb. Datorită acelorași forțe, ionii se pot mișca în soluții sub acțiunea unui curent electric constant. Și acum rețineți că moleculele de apă sunt dipoli (vezi figura 18), adică încărcăturile pozitive și negative din molecula de apă sunt deconectate și sunt în diferite părți ale acesteia. Prin urmare, ionii pot interacționa cu aceste încărcături și pot forma compuși.
Procesul de formare a unui compus de ioni cu molecule de apă se numește hidratare. Substanțele rezultate se numesc hidrați.
Hidrații cristalini solizi, formați în timpul evaporării lente a apei din soluții, se numesc hidrați cristalini.
Hidrații cristalini, de regulă, au o compoziție permanentă. Astfel, hidratul cristalin - sulfatul de cupru - reține cinci molecule de apă CuS04-5H20. Exemple de alte hidrați cristalini: FeS04-7H20; Na2CO3-10H2O.
Procesul de hidratare se datorează mișcării ionilor și a moleculelor de apă polară. Forțele care țin particulele una lângă cealaltă sunt de asemenea electrice.
Procesul de hidratare poate fi comparat cu formarea legăturilor ionice, deoarece forțele care dețin molecule de apă și ioni sunt Coulomb. Prin urmare, în timpul hidratării, energia este eliberată. Soluția trebuie încălzită. Și într-adevăr, prin dizolvarea acizilor, a alcalinelor și a unor săruri, soluția devine evidentă fierbinte. Deci, când se dizolvă acidul sulfuric, se eliberează atât de multă căldură încât soluția se poate fierbe. De aceea, din motive de siguranță, atunci când se diluează acidul sulfuric concentrat, acesta trebuie turnat în porții mici în apă. Densitatea acidului sulfuric este mai mare decât cea a apei, așa că se va scufunda în fundul vasului. Încălzirea soluției va avea loc mai uniform și nu se va fierbe.
Împreună cu hidratarea, atunci când se dizolvă substanțe în apă, se știe că ele sunt zdrobite și difuzate de particule de materie în tot volumul soluției. În timpul acestor procese, soluția trebuie răcită, deoarece efectuează lucrarea de strivire a cristalelor. Există substanțe, de exemplu, nitrați, atunci când sunt dizolvați în apă, temperatura soluției este redusă semnificativ. Efectul termic total al dizolvării substanțelor depinde de cantitatea de energie degajată de hidratare și de energia absorbită de strivire. Dacă în timpul hidratării se eliberează mai multă energie decât este folosită pentru zdrobirea substanței, soluția se încălzește. Dacă, dimpotrivă, energia este consumată mai mult decât cantitatea de energie eliberată prin hidratare, soluția este răcită.
1. Proprietățile atomilor și ionilor sunt semnificativ diferite. Acest lucru se datorează diferenței în structura cojilor de electroni și prezența încărcărilor în ioni.
2. Ionii care sunt mișcați de acțiunea curentului direct la catod se numesc cationi, iar cei care se mișcă în anod se numesc anioni.
3. În procesul de dizolvare, în plus față de zdrobirea și difuzia substanțelor, are loc hidratarea, adică interacțiunea dintre moleculele de apă polară și ioni. Ca urmare a acestui proces se formează hidrați.
4. Hidrații solizi, care includ molecule de apă în cristalele lor, se numesc hidrați cristalini.
5. Efectul termic al dizolvării substanțelor depinde de cantitatea de energie consumată pentru zdrobirea substanței și de energia eliberată prin hidratare.
Articole similare
Trimiteți-le prietenilor: